
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A.2.0gCO2与SO2的混合气体分子中,含有的质子数为NA
B.7.1gCl2与100mL1.0mol·L-1NaOH溶液反应,转移电子数为0.1NA
C.17gNH3与48gO2在催化剂作用下充分反应,得到NO分子数为NA
D.标准状况下,2.24LCH4和C3H6混合气体中,含有极性键数为0.5NA
【答案】A
【解析】
A、若2.0g全为CO2,含质子物质的量为![]() ×22=1mol,若2.0g全为SO2,含质子物质的量为
×22=1mol,若2.0g全为SO2,含质子物质的量为![]() ×32=1mol,则2.0gCO2与SO2的混合气体分子中含有的质子数为NA,A项正确;
×32=1mol,则2.0gCO2与SO2的混合气体分子中含有的质子数为NA,A项正确;
B、7.1gCl2的物质的量为0.1mol,100mL1.0mol·L-1NaOH为0.1mol,1mol氯气与2molNaOH反应转移1mol电子,故转移的电子数小于0.1NA,B项错误;
C、n(NH3)=![]() ,n(O2)=
,n(O2)=![]() ,依据方程式:4NH3+5O2
,依据方程式:4NH3+5O2![]() 4NO+6H2O可知,该反应生成1molNO,同时过量0.25molO2,则生成的一氧化氮部分与氧气反应生成二氧化氮(2NO+O2=2NO2),所以最终生成一氧化氮分子数小于NA,C项错误;
4NO+6H2O可知,该反应生成1molNO,同时过量0.25molO2,则生成的一氧化氮部分与氧气反应生成二氧化氮(2NO+O2=2NO2),所以最终生成一氧化氮分子数小于NA,C项错误;
D、n(混合气体)=2.24L÷22.4L/mol=0.1mol,若全为CH4则含极性键为0.4mol,若全为C3H6则含极性键0.6mol,由于CH4和C3H6的比例未知,则含极性键数无法确定,D项错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的数值,下列说法正确的是( )
为阿伏加德罗常数的数值,下列说法正确的是( )
A.100g 46%甘油水溶液中含—OH的数目为1.5NA
B.1.7g由NH3与13CH4组成的混合气体中含质子总数为NA
C.0.1molL-1的Al2(SO4)3溶液中含Al3+的数目小于0.2 NA
D.反应CH4 + 2NO + O2 = CO2 + N2 + 2H2O,每消耗标准状况下22.4L NO,反应中转移的电子数目为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位学生利用原电池反应检测金属的活动性顺序,两人都使用镁片与铝片作电极,但甲同学将电极放入6mol·L-1硫酸溶液中,乙同学将电极放入6mol·L-1的氢氧化钠溶液中,如图所示。
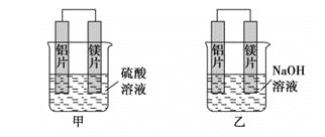
(1)写出甲池中正极的电极反应式__。
(2)写出乙池中负极的电极反应式__。
(3)写出乙池中总反应的离子方程式__。
(4)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出__活动性更强,而乙会判断出__活动性更强(填写元素符号)。
(5)由此实验,可得到如下哪些结论正确(________)
A.利用原电池反应判断金属活动顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
(6)上述实验也反过来证明了“直接利用金属活动顺序判断原电池中的正负极”这种做法__(可靠或不可靠)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案__(如可靠,此空可不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=____,ΔH=___(填“<”、“>”或“=”)0。
(2)830℃时,向一个5 L的密闭容器中充入0.20molA和0.80molB,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=____mol·L-1,C的物质的量为___mol;若反应经一段时间后,达到平衡时A的转化率为____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_____。
(3)判断该反应是否达到平衡的依据为_____。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有三个不成对的电子;C元素可分别与A、B、D生成RC2型化合物,其中的DC2与C3互为等电子体。下列叙述中不正确的是
A. D原子的简化电子排布式为[Ar]3s23p4
B. B、C两元素的第一电离能大小关系为B>C
C. 用电子式表示AD2的形成过程为![]()
D. 由B60分子形成的晶体与A60相似,分子中总键能:B60>A60
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,CH4和CO燃烧的热化学方程式分别为:
CH4(g)+2O2(g)![]() 2H2O(l)+CO2(g) ΔH =﹣890 kJ/mol
2H2O(l)+CO2(g) ΔH =﹣890 kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH =﹣566 kJ/mol
2CO2(g) ΔH =﹣566 kJ/mol
如果有CH4和CO的混合气体充分燃烧,放出的热量为262.9 kJ,生成的CO2用过量的饱和石灰水完全吸收,得到50g白色沉淀。则混合气体中CH4和CO的体积比为( )
A.1∶2B.1∶3C.2∶3D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,配制一组c(H2A)+c(HA-)+c(A2-)=0.10mol·L-1的H2A和NaOH的混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法中正确的是( )
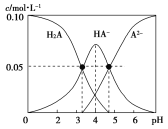
A.在c(Na+)=0.10mol·L-1的溶液中:c(A2-)-c(H+)=c(H2A)-c(OH-)
B.pH=4的溶液中:c(HA-)=c(H2A)+c(A2-)
C.pH=7的溶液中:c(Na+)=c(A2-)+c(HA-)
D.Ka1(H2A)的数量级为10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼及其合金在冶金、电器等方面有广泛应用。在1L恒容密闭容器中充入足量的Na2CO3、MoS2和H2,发生反应:MoS2(s)+2Na2CO3(s)+4H2(g)Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H,测得在不同温度下H2的物质的量与时间关系数据如表所示:下列说法错误的是( )
min mol K | 0 | 10 | 20 | 30 | 40 |
T1 | 2 | 1.6 | 1.3 | 1.0 | 1.0 |
T2 | 2 | 1.2 | 1.0 | n | 0.6 |
A.T2>T1,△H<0
B.表格中n=0.6
C.T2K下20min时,v正>v逆
D.T1K下平衡常数K=0.25(molL-1)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com