
����Ŀ����һ�������£�CH4��COȼ�յ��Ȼ�ѧ����ʽ�ֱ�Ϊ��
CH4(g)+2O2(g)![]() 2H2O(l)+CO2(g) ��H =��890 kJ/mol
2H2O(l)+CO2(g) ��H =��890 kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ��H =��566 kJ/mol
2CO2(g) ��H =��566 kJ/mol
�����CH4��CO�Ļ��������ȼ�գ��ų�������Ϊ262.9 kJ�����ɵ�CO2�ù����ı���ʯ��ˮ��ȫ���գ��õ�50g��ɫ����������������CH4��CO�������Ϊ���� ����
A.1��2B.1��3C.2��3D.3��2
 �����Ļ�������ҵϵ�д�
�����Ļ�������ҵϵ�д� ����������������ϵ�д�
����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������N2H4���ʹ������ƣ�NaH2PO2��������ǿ��ԭ�ԣ������Ź㷺����;��
(1)��֪����N2H4(1)+O2(g)��N2(g)+2H2O(g) ��H1=-621.5kJmol-1
��N2O4(1)��N2(g)+2O2(g) ��H2=+204.3kJmol-1
����ȼ�ϵ�ȼ�շ�ӦΪ2N2H4(1)+N2O4(1)��3N2(g)+4H2O(g) ��H=__��
(2)��֪��ӦN2H4(g)+2Cl2(g)![]() N2(g)+4HCl(g)��T��ʱ����2L�����ܱ������м���2molN2H4(g)��4molCl2(g)�����Cl2��HCl��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
N2(g)+4HCl(g)��T��ʱ����2L�����ܱ������м���2molN2H4(g)��4molCl2(g)�����Cl2��HCl��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��

��0��10min�ڣ���N2(g)��ʾ��ƽ����Ӧ����v(N2)=__��
��M��ʱ��N2H4��ת����Ϊ__����ȷ��0.1��%��
��T��ʱ���ﵽƽ�������������м���1.2molN2H4(g)��0.4molCl2(g)��0.8molN2(g)��1.2molHCl(g)����ʱƽ��__��������ƶ����������ƶ������ƶ�������
(3)�ٴ����ᣨH3PO2����һԪ�ᣬ�����£�1.0molL-1��NaH2PO2��ҺpHΪ8����������Ka=__��
���ô�������ͨ�����������Ʊ������ᣬװ����ͼ��ʾ������ĤA����__���������ӡ��������ӡ�������Ĥ���缫N�ĵ缫��ӦʽΪ___��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����ݻ�Ϊ1L�������ڣ�ijһ��Ӧ��M��N�����ʵ����淴Ӧʱ��仯��������ͼ��ʾ�������б�������ȷ���ǣ� ��

A.�÷�Ӧ�Ļ�ѧ����ʽΪ2M![]() N
N
B.t2ʱ�������淴Ӧ������ȣ��ﵽƽ��
C.t3ʱ������Ӧ���ʴ����淴Ӧ����
D.t1ʱ��N��Ũ����MŨ�ȵ�2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�������ֵ������˵����ȷ����
A.2.0gCO2��SO2�Ļ����������У����е�������ΪNA
B.7.1gCl2��100mL1.0mol��L��1NaOH��Һ��Ӧ��ת�Ƶ�����Ϊ0.1NA
C.17gNH3��48gO2�ڴ��������³�ַ�Ӧ���õ�NO������ΪNA
D.��״���£�2.24LCH4��C3H6��������У����м��Լ���Ϊ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�������ijһ��Ӧ��M��N�����ʵ����淴Ӧʱ��仯����������ͼ��
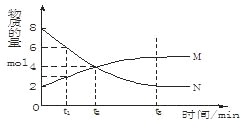
���б�������ȷ����
A.��Ӧ�Ļ�ѧ����ʽΪ�� M![]() NB.t2ʱ�����淴Ӧ������ȣ��ﵽƽ��
NB.t2ʱ�����淴Ӧ������ȣ��ﵽƽ��
C.t3ʱ������Ӧ���ʴ����淴Ӧ����D.t1ʱ��N��Ũ����MŨ�ȵ�2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���й����ʵĵ���ƽ�ⳣ�����£�
��ѧʽ | CH3COOH | H2CO3 | H2SO3 |
����ƽ�ⳣ��K | K=1.8��10-5 | K1=4.3��10-7 K2=5.6��10-11 | K1=1.5��10-2 K2=1.02��10-7 |
��1���������ǿ����˳��Ϊ_________________(�û�ѧʽ��ʾ����ͬ)��
��2�������£�0.02 mol��L-1��CH3COOH��Һ�ĵ����ԼΪ �����Ϊ10mLpH=2�Ĵ�����Һ����������Һ�ֱ������ˮϡ����1000mL��ϡ�ͺ���Һ��pH��ǰ�� ����(���������������=��)��
��3����������CH3COO-��CO32-��HSO3-��SO32-����Һ�н��H+�������ɴ�С��˳��Ϊ_____________��
��4��NaHSO3��Һ�����Ե�ԭ��___________________________(���ӷ���ʽ���ʵ���������)������Һ������Ũ���ɴ�С�Ĺ�ϵ��_______________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ���ܴ���������ǣ�������
A. pH=1����Һ�У�Fe2+��NO3����Na+��SO42��
B. ˮ�������c��H+��=10��12mol/L����Һ�У�Ca2+��K+��Cl����HCO3��
C. c��H+��/c��OH����=1012��ˮ��Һ�У�NH4+��Al3+��NO3����Cl��
D. c��Fe3+��=0.1mol/L����Һ�У�K+��ClO����SO42����SCN-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CaCO3�㷺��������Ȼ�磬��һ����Ҫ�Ļ���ԭ�ϡ�����ʯ��Ҫ�ɷ�ΪCaCO3�������������ĺ����ʵ�����ô���ʯ��ϡ���ᷴӦ�Ʊ�CO2���塣����װ�ÿ�����CO2������ᴿ������������գ�

��1����Ũ��������1:1������ȣ���ϡ���ᣨԼ6 mol��L-1������Ҫ�IJ���������___________
��2������װ���У�A��___________��Һ����������___________ ��
��3������װ���У�B������___________��
��4��һ���Է�����ʯ����CaCO3��ʳ���е��ܳ��������۷���������ָ��֮һ���ⶨ�ܳ�������Ҫʵ�鲽��������£����顢���ء������ܽ�����ˡ�������ɡ���ȴ�����ء�����
�ٴ����ʷ���ĽǶȷ�����ʯ�������л����е�____________�࣬Ϊ�˽�ʯ���ӷ������ܳ���Ӧѡ�������Լ��е�__________��
a���Ȼ�����Һ b��ϡ���� c��ϡ���� d ������
�ڷ����е�̼��Ƴ���ϡ���Ὣ���ܳ�����д���䷴Ӧ�����ӷ���ʽ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ZrO2�������մɲ��ϣ������Ӣɰ(��Ҫ�ɷ�ΪZrSiO4����������FeCO3��Fe2O3��Al2O3��SiO2������)ͨ������������ȡ��
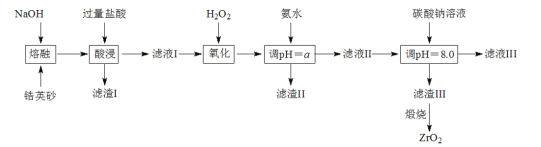
��֪����ZrSiO4�����ռӦ����Na2ZrO3��Na2SiO3��Na2ZrO3���ᷴӦ����ZrO2+
�ڲ��ֽ���������ʵ�������¿�ʼ��������ȫ������pH���±���
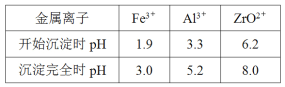
(1)�������������У� ZrSiO4������Ӧ�Ļ�ѧ����ʽ��______________________����I�Ļ�ѧʽΪ_______________
(2)�������������У�������Ӧ�����ӷ���ʽ��__________________����pH=a��ʱ��a�ķ�Χ��________________
(3)Ϊ�õ�������ZrO2��������Ҫ��ˮϴ����������Ƿ�ϴ�Ӹɾ��ķ�����________________
(4)������ijɷ���Zr(CO3)2��xZr(OH)4ȡ�ɲٺ�������� 37.0g�����պ�ɵõ�24.6 g ZrO2��x����____________________������pH=8.0��ʱ����������Ӧ�����ӷ���ʽΪ________ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com