
����Ŀ��ZrO2�������մɲ��ϣ������Ӣɰ(��Ҫ�ɷ�ΪZrSiO4����������FeCO3��Fe2O3��Al2O3��SiO2������)ͨ������������ȡ��
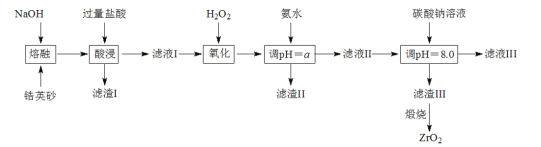
��֪����ZrSiO4�����ռӦ����Na2ZrO3��Na2SiO3��Na2ZrO3���ᷴӦ����ZrO2+
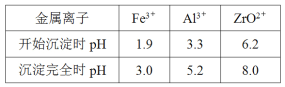
�ڲ��ֽ���������ʵ�������¿�ʼ��������ȫ������pH���±���
(1)�������������У� ZrSiO4������Ӧ�Ļ�ѧ����ʽ��______________________����I�Ļ�ѧʽΪ_______________
(2)�������������У�������Ӧ�����ӷ���ʽ��__________________����pH=a��ʱ��a�ķ�Χ��________________
(3)Ϊ�õ�������ZrO2��������Ҫ��ˮϴ����������Ƿ�ϴ�Ӹɾ��ķ�����________________
(4)������ijɷ���Zr(CO3)2��xZr(OH)4ȡ�ɲٺ�������� 37.0g�����պ�ɵõ�24.6 g ZrO2��x����____________________������pH=8.0��ʱ����������Ӧ�����ӷ���ʽΪ________ ��
���𰸡�ZrSiO4+4NaOH=Na2ZrO3+Na2SiO3+2H2O H2SiO3 2Fe2++H2O2+2H+=2Fe3++2H2O 5.2��a<6.2 ȡ���һ��ϴ��Һ���Թ��У����������ữ��AgNO3��Һ�����ް�ɫ��������˵����ϴ�ɾ� 1 2ZrO2++2CO32-+2H2O=Zr(CO3)2��Zr(OH)4��
��������
�Ӣɰ����Ҫ�ɷ�ΪZrSiO4����������FeCO3��Fe2O3��Al2O3��SiO2�����ʣ�����NaOH���ڣ�ZrSiO4ת��ΪNa2SiO3��Na2ZrO3��������ת��ΪNaAlO2��SiO2ת��ΪNa2SiO3��Fe2O3����Ӧ���ټӹ������������Na2ZrO3���ᷴӦ����ZrO2+��Na2SiO3��HCl���ɹ��������ƫ������ת��Ϊ�Ȼ�����̼��������������ת��Ϊ�Ȼ��������Ȼ��������˷��룬����IΪ���ᣬ��Һ�к���ZrO2+��Fe2+��Fe3+��Al3+��Na+��Cl-�ȣ�����������������������ӣ��Ӱ�ˮ����pH��ʹFe3+��Al3+ת��Ϊ����������������˷�������IIΪ����������������������Һ����Ҫ����ZrO2+��NH4+��Cl-��Na+��Cl-�ȣ��ټӰ�ˮ����pH��ʹZrO2+ת��ΪZr��OH��4���������ˡ�ϴ�ӡ�����õ�Zr��OH��4�����ȷֽ⼴�ɵõ�ZrO2���Դ˽����⡣
��1���������Ϣ֪�� ZrSiO4��NaOH��Ӧ����Na2SiO3��Na2ZrO3���䷴Ӧ�ķ���ʽΪ��ZrSiO4+4NaOH=Na2ZrO3+Na2SiO3+2H2O���ӹ������������Na2SiO3��HCl���ɹ�����������ˣ�����IΪH2SiO3���ʴ�Ϊ��ZrSiO4+4NaOH=Na2ZrO3+Na2SiO3+2H2O��H2SiO3��
��2���������������У�˫��ˮ�����������½�Fe2+����ΪFe3+����Ӧ�����ӷ���ʽ��2Fe2++H2O2+2H+=2Fe3++2H2O������pH����ʹ�����Ӻ���������ȫ��������Ҫ��������Zr(OH)4���ɱ������ݿ�֪pH�ķ�ΧΪ5.26.2���ʴ�Ϊ��2Fe2++H2O2+2H+=2Fe3++2H2O��5.2��a<6.2��
��3��Zr(OH)4����Ϊ����Cl-�ȣ�����Zr(OH)4�Ƿ�ϴ�Ӹɾ��ķ����ǣ�ȡ���һ��ϴ��Һ���Թ��У����������ữ��AgNO3��Һ�����ް�ɫ��������˵����ϴ�ɾ����ʴ�Ϊ��ȡ���һ��ϴ��Һ���Թ��У����������ữ��AgNO3��Һ�����ް�ɫ��������˵����ϴ�ɾ���
��4��������ijɷ���Zr(CO3)2xZr(OH)4��ȡ�ɲٺ��������37.0g�����պ�ɵõ�24.6gZrO2����![]() ��x=1������pH=8.0��ʱ����Ӧ����Zr(CO3)2��Zr(OH)4������������Ӧ�����ӷ���ʽΪ��2ZrO2++2CO32-+2H2O=Zr(CO3)2��Zr(OH)4�����ʴ�Ϊ1��2ZrO2++2CO32-+2H2O=Zr(CO3)2��Zr(OH)4����
��x=1������pH=8.0��ʱ����Ӧ����Zr(CO3)2��Zr(OH)4������������Ӧ�����ӷ���ʽΪ��2ZrO2++2CO32-+2H2O=Zr(CO3)2��Zr(OH)4�����ʴ�Ϊ1��2ZrO2++2CO32-+2H2O=Zr(CO3)2��Zr(OH)4����


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�CH4��COȼ�յ��Ȼ�ѧ����ʽ�ֱ�Ϊ��
CH4(g)+2O2(g)![]() 2H2O(l)+CO2(g) ��H =��890 kJ/mol
2H2O(l)+CO2(g) ��H =��890 kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ��H =��566 kJ/mol
2CO2(g) ��H =��566 kJ/mol
�����CH4��CO�Ļ��������ȼ�գ��ų�������Ϊ262.9 kJ�����ɵ�CO2�ù����ı���ʯ��ˮ��ȫ���գ��õ�50g��ɫ����������������CH4��CO�������Ϊ���� ����
A.1��2B.1��3C.2��3D.3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������·�ӦmA(g)+nB(g)![]() pC(g)+qD(g)��һ�ܱ������н��У����ƽ����Ӧ�ٶ�v(C)=2v(B)������Ӧ��ƽ����¶Ȳ��䣬�Ӵ���ϵѹǿʱƽ�ⲻ�ƶ�����m��n��p��q����ֵ�����ǣ� ��
pC(g)+qD(g)��һ�ܱ������н��У����ƽ����Ӧ�ٶ�v(C)=2v(B)������Ӧ��ƽ����¶Ȳ��䣬�Ӵ���ϵѹǿʱƽ�ⲻ�ƶ�����m��n��p��q����ֵ�����ǣ� ��
A.2��6��3��5B.3��1��2��2
C.3��1��2��1D.1��3��2��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⼰��Ͻ���ұ�𡢵����ȷ����й㷺Ӧ�á���1L�����ܱ������г���������Na2CO3��MoS2��H2��������Ӧ��MoS2(s)+2Na2CO3(s)+4H2(g)Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ��H������ڲ�ͬ�¶���H2�����ʵ�����ʱ���ϵ���������ʾ������˵��������ǣ� ��
min mol K | 0 | 10 | 20 | 30 | 40 |
T1 | 2 | 1.6 | 1.3 | 1.0 | 1.0 |
T2 | 2 | 1.2 | 1.0 | n | 0.6 |
A.T2��T1����H��0
B.������n=0.6
C.T2K��20minʱ��v����v��
D.T1K��ƽ�ⳣ��K=0.25��molL-1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС�����ʵ��̽��SO2��Ư�۾���Ӧԭ����װ����ͼ��ʾ����
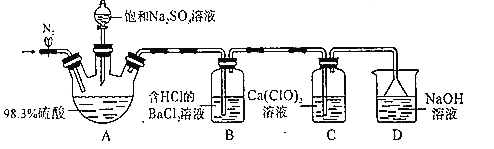
ʵ������������£�
����1������װ�ò����װ�������ԣ�����ͼ��ʾװ��ҩƷ��
����2����ֹˮ�У���װ����ͨ��һ��ʱ��N2�����ر�ֹˮ�У�
����3��ȡ�·�Һ©�������ӣ���ת������������ƿ�еμӱ���Na2SO3��Һ����һ������۲쵽B��C�ж�������ɫ����
����4��ʵ����Ϻ���C�а�ɫ���壬��ɫ������CaSO4��
�ش��������⣺
��1��Bװ���������������__����֤��A�в�����������������H2SO4��ʵ��������___��
��2��A��������ֳ�����������__��
��3������2��ͨ��N2��Ŀ����__��
��4��ʵ����Ϻ����飬D����Һ���е����ʵ���Ũ�ȵ����ֻ�ԭ���Σ�д���ܷ�Ӧ�����ӷ���ʽ__��
��5������4����C�а�ɫ�����ɷֵIJ����ǣ�ȡ����C�а�ɫ���壬�μ�����___�������ƣ�������ɫ���岻�ܽ⣬���ɫ������CaSO4��
��6����������C�з�����ѧ��Ӧ�뷴Ӧ��������йأ�
��ͨ������SO2��������ӦΪ3Ca(ClO)2+2SO2+2H2O�T2CaSO4��+4HClO+CaCl2��
��ͨ�����SO2��������ӦΪCa(ClO)2+2SO2+2H2O�TCaSO4��+H2SO4+2HCl��SO2+H2OH2SO3��
���ʵ��֤������C��ͨ�����SO2��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���100 mL 0.01 mol��L��1 HA��Һ����μ���0.02 mol��L��1 MOH��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯�����ϡ��Һ���ʱ�����ֱ����ӣ��������жϴ������
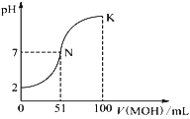
A. ��ͼ����Ϣ��֪��HAһ����ǿ��
B. ��V(MOH)��50.00 mLʱ�������Һ��c(M��)��c(MOH)��0.01 mol��L��1
C. N���Ӧ����Һ��c(M��)��c(A��)
D. K������Ӧ����Һ������Ũ�ȴ�С��ϵΪ��c(M+)��c(A��)��c(OH��)��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����Ĺ����������Ҫ��Cu��CuO������������Cu2O��SiO2�ȡ����øù��������ȡCu ��NO3��2�IJ��ֹ���������ͼ��ʾ��

��1��Cu��ϡ���ᷴӦ�����ӷ���ʽΪ ��
��2������ʱ����Ӧ�¶Ȳ��˳���70��������Ҫԭ���� �������ַ�Ӧ�¶�Ϊ70�������ӿ췴Ӧ���ʿɲ�ȡ�Ĵ�ʩΪ ��д2������
��3�����˺����÷�������Ҫ�ɷֵĻ�ѧʽΪ ��
��4����Cu��NO3��2��Һ��Cu��NO3��2����IJ��������ǣ�����Ũ���� �����ˡ���ˮϴ�ӡ����º�ɡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D���ֶ�����Ԫ�ص�ԭ��������������A ��һ�ֺ����ڿ���ʱ����������һЩ����������B����̬�⻯���ˮ��Һ�ʼ��ԣ�CΪ����Ԫ���������ֳ��������������������Ԫ�أ�������D���ʵ�ˮ��Һ�еμ�������ɫʯ����Һ���ɹ۲쵽�ȱ�����ɫ������˵������ȷ����
A. C�����ֺ������������������Ӹ����ȶ�Ϊ1��2
B. ����������Ӧ��ˮ���������B>D
C. B���⻯��ķе�һ������A���⻯��
D. ԭ�Ӱ뾶D>A>B>C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��A��B��C��D��E��F����Ԫ�غ˵�����������������ڱ���ǰ�����ڵ�Ԫ�ء�����Aԭ�Ӻ���������δ�ɶԵ��ӣ�������B2E�ľ���Ϊ���Ӿ��壬Eԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ�CԪ���ǵؿ��к�����ߵĽ���Ԫ�أ�D���ʵ��۵���ͬ����Ԫ���γɵĵ�������ߣ�F���γɺ�ɫ(��ש��ɫ)��F2O�ͺ�ɫ��FO���������
�ش��������⣺
(1)F��ԭ�ӵ�M������Ų�ʽΪ ��
(2)B��C��D�ĵ�һ��������С�����˳��Ϊ ��(��Ԫ�ط��ű�ʾ)
(3)A�ļ��⻯����Ӽ�������ˮ������Ҫԭ���� ��
(4)E�������������ӵĿռ乹���� ��������ԭ�ӵ��ӻ���ʽΪ ��
(5)F�ĸ�������A�ļ��⻯���γɵ������ӣ������ǿռ乹�ͣ������ӵĽṹ����ʾ��ͼ��ʾΪ ��

(6)A��F�γ�ij�ֻ�����ľ����ṹ��ͼ��ʾ�����仯ѧʽΪ ��(��ɫ���ʾFԭ��)����֪���ڵİ��������֮��ľ���Ϊa cm���þ������ܶ�Ϊ g/cm3��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com