
【题目】甲醛是危害人类的无形杀手,是一种重要的工业原料。
(1)甲醛(H2C![]() O)在Ni的催化作用下加氢可得甲醇(CH3OH)。甲醛与甲醇相比,__________的沸点高,主要原因是__________
O)在Ni的催化作用下加氢可得甲醇(CH3OH)。甲醛与甲醇相比,__________的沸点高,主要原因是__________
(2)甲醛分子的空间构型为__________,其分子内的O—C — H键角__________(填“大于”“等于”或“小于”)甲醇分子内的O—C — H键角。
(3)甲醛分子是__________(填“极性分子”或“非极性分子”),它可由CO与H2在一定条件下反应合成。CO与N2的结构相似,一个CO分子内![]() 键的个数为__________,基态氧原子的价电子排布式是__________
键的个数为__________,基态氧原子的价电子排布式是__________
【答案】甲醇甲醇分子间形成了氢键平面三角形大于极性分子22s22p4
【解析】
(1)在甲醇分子中存在O-H键,氧的电负性较大,能形成氢键,而甲醛分子没有氢键,故甲醇的沸点较高,故答案为:甲醇、甲醇分子间形成了氢键;
(2)甲醇分子内C原子的杂化方式为sp3杂化,所以O-C-H键角约为109°28′,甲醛分子内的C原子的杂化方式为sp2杂化,空间构型为平面三角型结构,O-C-H键角约为120°,所以甲醇分子内的O-C-H键角小于甲醛分子内的O-C-H键角,故答案为:平面三角形、大于;
(3)甲醛分子中正负电荷的重心并不重合,为极性分子;CO与N2分子中都存在三键,故分别有一个σ键和两个π键;基态氧原子的价电子排布式是为2s22p4,故答案为:极性分子、 2 、2s22p4。


科目:高中化学 来源: 题型:
【题目】某实验过程如图所示:则图③的试管中的现象是
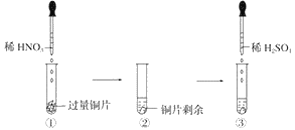
A. 无明显现象,因稀硫酸不与铜反应
B. 铜片溶解,产生无色气体,该气体遇到空气不变色
C. 铜片溶解,放出红棕色有刺激性气味的气体
D. 铜片溶解,产生无色气体,该气体在试管口变为红棕色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y的核电荷数分别是a和b,它们的离子Xn+和Ym-的核外电子排布相同,则下列关系式中正确的是( )
A. a=b+m+n B. a=b-m+n
C. a=b+m-n D. a=b-m-n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)B为__________(填写元素符号),D的最高价氧化物对应的水化物是_________(填写化学式),离子半径大小B_________C(填“>”“<”或“=”);
(2)写出A、B的化合物与E反应的化学方程式:______________________;A、B两元素形成的化合物属于_________(填“离子”或“共价”)化合物。
(3)A的单质与D的最高价氧化物对应的水化物反应的化学方程式为_______________。
Ⅱ.常温下由三种短周期元素形成的气体单质X、Y、Z,有下列转化关系(反应条件已略去):

已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子。
(4)化合物甲的电子式是_____________;化合物丙中存在的化学键为___________、_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于某些离子的检验及结论中一定正确的
A. 加入稀盐酸产生无色的气体,将气体通入澄清石灰水中,溶液变浑浊,一定有![]()
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有![]()
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有![]()
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中发生如下可逆反应:2X(g)+Y(s)![]() 3Z(g) ΔH= QkJ/mol,下列说法正确的是
3Z(g) ΔH= QkJ/mol,下列说法正确的是
A. 消耗2 mol X同时生成3 mol Z,说明达到了平衡状态
B. 加入少量的Y正反应速率加快
C. 气体的密度不变时,说明达到了平衡状态
D. 加入少量的X,Q变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出C1O2,C1O2有类似Cl2的性质。某兴趣小组探究亚氯酸钠的制备与性质。

Ⅰ.制备亚氯酸钠
关闭止水夹②,打开止水夹①,从进气口通入足量C1O2,充分反应。
(1)仪器a的名称为_______,仪器b的作用是_____。
(2)装置A中生成NaC1O2的离子方程式为_______。
(3)若从装置A反应后的溶液中获得NaClO2晶体,则主要操作有减压蒸发浓缩、降温结晶______、_____干燥等。
Ⅱ.探究亚氯酸钠的性质
停止通ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
(4)开始时A中反应缓慢,稍后产生气体的速率急剧加快,请解释可能的原因_________。
(5)B中现象为_________ 。
(6)实验完成后,为防止装置中滞留的有毒气体污染空气,可以进行的操作是:再次打开止水夹①,_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如下图1,电池的工作原理如下图2。下列有关说法正确的是
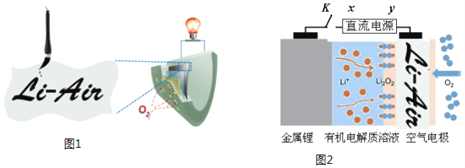
A. 放电时,纸张中的纤维素作锂电池的正极
B. 开关K闭合给锂电池充电,X为直流电源负极
C. 放电时,Li+由正极经过有机电解质溶液移向负极
D. 充电时,阳极的电极反应式为:Li2O2+2e-=O2↑+2Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为 1857 ℃。
(1)工业上以铬铁矿[主要成分是 Fe(CrO2)2]为原料冶炼铬的流程如图所示:

①Fe(CrO2)2中各元素化合价均为整数,则铬为_____价。
②高温氧化时反应的化学方程式为 ____。
③操作 a 由两种均发生了化学反应的过程构成的,其内容分别是_____、铝热反应。
(2)Cr(OH)3 是两性氢氧化物,写出其分别与 NaOH、稀盐酸反应时生成的两种盐的化学式_____。
(3)铬元素能形成含氧酸及含氧酸盐,初始浓度为 1mol·L1 的铬酸(H2CrO4)溶液中,测得所有含铬元素的微粒及浓度分别为: c(CrO42-)=0.0005 mol·L-1、c(HCrO4-)=0.1055 mol·L-1、c(Cr2O72-)=a mol·L-1。
①a= ____。
②KHCrO4 溶液中,c(H+)_____c(OH-) (填“>”、“<”或“=”)。
(4)某工厂采用电解法处理含 Cr2O72-的废水,耐酸电解槽用铁板作阴、阳极,槽内盛放含铬废水,Cr2O72-被还原成为 Cr3+,Cr3+在阴极区生成 Cr(OH)3 沉淀除去,工作原理

①写出电解时阴极的电极反应式 ____。
②电解装置中的隔膜为 ____ (填阴或阳)离子交换膜。
③写出 Cr2O72-被还原为 Cr3+的离子方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com