
【题目】【2014新课标2】一定温度下,下列溶液的离子浓度关系式正确的是
A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:
c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
【答案】D
【解析】判断电解质溶液中离子浓度大小关系首先要确定电解质溶液的成分,是单一溶液还是混合溶液,若是两溶液混合,要理清是简单混合,还是有反应发生,理清溶液的最终组成;其次要分析溶液中存在的电离平衡、水解平衡等平衡,不可忽略水的电离平衡,然后结合相关信息判断平衡的主次,抓住弱电解质的电离及盐类的水解是微弱等特点做出判断;涉及等式关系要注意物料守恒式、电荷守恒式及质子守恒式的应用。结合选项逐个分析。A、H2S为二元弱酸,H2S溶液中存在H2S ![]() H+ + HS-、HS-
H+ + HS-、HS- ![]() H+ + S2-、H2O
H+ + S2-、H2O![]() H+ + OH-,一级电离程度远大于二级电离程度,根据上述分析知,pH=5的H2S溶液中,c(H+)=1×10—5 mol·L—1> c(HS-),错误;B、一水合氨为弱电解质,加水稀释,促进其电离,稀释过程中pH变化比强碱溶液稀释pH变化小。pH=a的氨水溶液,稀释10倍后,其pH=b,则a<b+1,错误;C、根据电荷守恒知,pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)+2 c( C2O42-),错误;D、已知酸性:CH3COOH>H2CO3>HClO,根据盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大,物质的量浓度相同时,溶液的碱性越强,PH越大,故pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的物质的量浓度:①>②>③,c(Na+):①>②>③,正确。
H+ + OH-,一级电离程度远大于二级电离程度,根据上述分析知,pH=5的H2S溶液中,c(H+)=1×10—5 mol·L—1> c(HS-),错误;B、一水合氨为弱电解质,加水稀释,促进其电离,稀释过程中pH变化比强碱溶液稀释pH变化小。pH=a的氨水溶液,稀释10倍后,其pH=b,则a<b+1,错误;C、根据电荷守恒知,pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)+2 c( C2O42-),错误;D、已知酸性:CH3COOH>H2CO3>HClO,根据盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大,物质的量浓度相同时,溶液的碱性越强,PH越大,故pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的物质的量浓度:①>②>③,c(Na+):①>②>③,正确。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列递变规律不正确的是( )
A.Na、Mg、Al的还原性依次减弱
B.I、Br、Cl的非金属性性依次增强
C.C,N,O 的原子半径依次增大
D.P,S,Cl的最高正化合价依次升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,下列说法正确的是

A. 0-t1时,原电池的负极是铜片
B. 0-t1时,正极的电极反应式是2H++2e-=H2↑
C. t1时刻,电流方向发生变化的原因是Al 在浓硝酸中发生钝化,氧化膜阻止了Al进一步反应
D. tl时刻后,电子从铝经过导线流向铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 2.0gH218O与D2O的混合物中所含中子数为NA
B. 50mL18mol·L-1浓硫酸与足量铜供热,转移电子数为0.9NA
C. 0.1molCl2通入含0.1molFeBr2溶液中,被氧化的溴离子数为0.2NA
D. 标准状况下,2.24LNO和足量O2反应生成物中含有NO2分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吡格雷(clopigogrel)是一种用于抑制血小板聚集的药物,以![]() 为原料合成氟吡格雷的路线如下图:
为原料合成氟吡格雷的路线如下图:
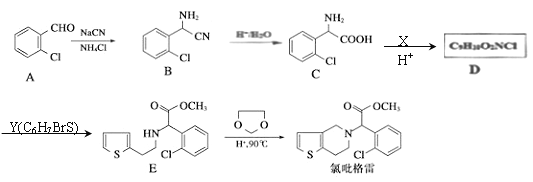
回答下列问题:
(1)A的名称为________________,D的结构简式为___________。
(2)化合物C在一定条件下可发生分子间成环反应生成含3个六元环的有机物,其化学方程式为_______。
(3)一定条件下,1分子Y与1分子HBr发生加成反应,生成的产物最多可能有__________种(不考虑立体异构);有E转化为F时,生成的另一种产物是______________。
(4)写出B的同分异构体中满足下列条件的任意一种有机物的结构简式_______________。
①含有两个-NH2的芳香族化合物;②核磁共振氢谱有3种吸收峰。
(5)结合上述流程写出以乙醇为有机物原料制备![]() 的合成路线流程图(无机试剂任选);_________________。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选);_________________。合成路线流程图示例如下:
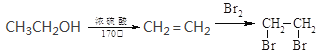
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016江苏卷】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L–1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1mol·L–1 Na2SO3溶液的pH约为10;0.1mol·L–1 NaHSO3溶液的pH约为5。 | HSO3–结合H+的能力比 SO32–的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
A.沸点:CH4>NH3>H2O
B.得电子能力:C>N>O
C.酸性:H2SO4>HClO4>H3PO4
D.碱性:NaOH>Mg(OH)2>Al(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com