
【题目】下列递变规律不正确的是( )
A.Na、Mg、Al的还原性依次减弱
B.I、Br、Cl的非金属性性依次增强
C.C,N,O 的原子半径依次增大
D.P,S,Cl的最高正化合价依次升高
科目:高中化学 来源: 题型:
【题目】已知723K时,2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-393.2 kJ/mol。维持723K,向一恒容的密闭容器A中通入2 mol SO2和1 mol O2,达到平衡时,放出热量Q1;维持723K,向另一个容积与A相同的恒容密闭容器B中通入1 mol SO2和0.5 mol O2,平衡时放出热量为Q2。下列判断不正确的是
2SO3(g) ΔH=-393.2 kJ/mol。维持723K,向一恒容的密闭容器A中通入2 mol SO2和1 mol O2,达到平衡时,放出热量Q1;维持723K,向另一个容积与A相同的恒容密闭容器B中通入1 mol SO2和0.5 mol O2,平衡时放出热量为Q2。下列判断不正确的是
A. 达到平衡时,以SO2表示的正反应速率A中比B中大
B. 达到平衡时,O2的转化率A中比B中大
C. 达到平衡时,混合气体的密度A中比B中小
D. 达到平衡时,放出的热量Q2< 1/2Q1 < 196.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质或应用均正确的是
A.二氧化硅为酸性氧化物,可用于制做计算机芯片
B.铜的金属活泼性比铁差,可在海轮外壳上装若干铜块以减缓其腐蚀
C.Zn具有还原性和导电性,可用作锌锰干电池的负极材料
D.浓硫酸具有脱水性,可用于干燥NH3、SO2等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种常见元素,其中X\、Y、Z为短周期元素,W为过渡元素,它们的相关信息如表:
原子或分子相关信息 | 单质及其化合物相关信息 | |
X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 |
Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种高温材料 |
Z | Z原子的最外层电子数是次外层电子数的 | Z广泛存在于无机非金属材料中,其单质是制取大规模集成电路的主要原料 |
W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
回答下列问题:
(1)W在周期表的位置为_________,W(OH)2在空气中不稳定,极易被氧化反应的化学方程式为_________________________________________。
(2)X的简单阴离子的结构示意图为___________________;X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为____________________________。
(3)Z的氧化物在通讯领域的用途是___________________,工业上制备Z的单质的化学反应方程式为 ___________________________________ 。
(4)YX3固体在熔融状态下不导电,则YX3固体中存在__________键;在50 mL l mol·L-1的YX3溶液中逐滴加入0.5 mol·L-1的NaOH溶液,得到1.56 g沉淀,则加入NaOH溶液的体积可能有________种情况。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015海南卷】氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2, 其△H= kJ·mol-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol·L-1。如果在甲瓶中加入少量的NaHCO3晶体(n mol),在乙瓶中加入少量的NaHSO3晶体(n mol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度的大小关系是(溶液体积变化忽略不计)( )
A. 甲=乙>丙 B. 甲>丙>乙 C. 丙>甲=乙 D. 乙>丙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,工业上可用NO与Cl2合成,回答下列问题:
(1)一定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及热化学方程式和平衡常数如下表:
序号 | 热化学方程式 | 平衡常数 |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+ Cl2(g) | K3 |
则ΔH3=_________(用ΔH1、ΔH2表示);K3=__________(用K1、K2 表示)
(2)300℃时,在一密闭容器中发生反应:2ClNO(g) ![]() 2NO(g)+ Cl2(g),其正反应速率表达式为v正=k·cn(ClNO)。测得速率和浓度的关系如下表:
2NO(g)+ Cl2(g),其正反应速率表达式为v正=k·cn(ClNO)。测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | v正/mol·L-1·s-1 |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
③ | 0.90 | 3.24×10-8 |
/p>
则n=________;k=___________;达到平衡后,若减小压强,则混合气体的平均分子量将_______(填“增大”、“减小”或“不变”)。
(3)25℃时,向体积为2L且带气压计的恒容密闭容器中通入0.08mol NO和0.04mol Cl2发生反应:2NO(g)+Cl2(g) ![]() 2ClNO(g) ΔH
2ClNO(g) ΔH
①若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图Ⅰ曲线a所示,则ΔH________0(填“>”、“<”或“不确定”);若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图Ⅰ曲线b所示,则改变的条件是___________。
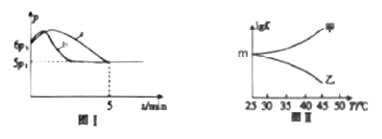
②图Ⅱ是甲、乙同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是____(填“甲”或“乙”);m值为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2014新课标2】一定温度下,下列溶液的离子浓度关系式正确的是
A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:
c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com