
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是
A. 32 g O2和O3的混合气体所含原子数为NA
B. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
C. 高温下,0.2mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
D. 在25℃、101kPa下,2 mol氧气和氢气的混合气体的体积约为44.8 L
【答案】B
【解析】
A. O2和O3分子都是由O原子构成的,由于O原子相对原子质量是16,所以32 g O2和O3的混合气体中含有O原子的物质的量是2mol,则所含原子数为2NA,A错误;
B.根据方程式可知:每反应产生4molN2,转移电子的物质的量为15mol,现在产生28gN2,其物质的量为1mol,则转移电子数目为(15mol÷4)×NA/mol=3.75NA,B正确;
C.高温下, Fe与水蒸气发生反应:3Fe+4H2O(g) ![]() Fe3O4+4H2,每有3molFe反应,产生4molH2,现在反应的Fe为0.2mol,所以生成的H2分子数目为(4mol÷3)×NA/mol> 0.3NA,C错误;
Fe3O4+4H2,每有3molFe反应,产生4molH2,现在反应的Fe为0.2mol,所以生成的H2分子数目为(4mol÷3)×NA/mol> 0.3NA,C错误;
D.25℃、101kPa不是标准状况,所以2mol气体的体积不是44.8L,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】下列物质分类的正确组合是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Cu2(OH)2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | NH3 | CaCl2 | MgO | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现有五种溶液,分别含下列离子:①Ag+,②Mg2+,③Fe2+,④Al3+,⑤Fe3+。
(1)写出符合下列条件的离子符号:既能被氧化又能被还原的离子是______,加铁粉后溶液增重的是____;
(2)向Fe2+的溶液中滴加NaOH溶液,现象是__________________。
(3)除去FeCl2中FeCl3中所涉及的离子方程式:________________。
II.(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是:____________,该实验证明起漂白作用的是______。(填化学式)
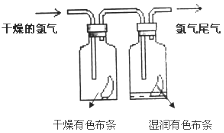
(2)①氯气有毒,实验室吸收多余的氯气的原理是(用离子方程式表示)__________________;
②根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是_________(填化学式)。
③长期露置于空气中的漂白粉会失效,失效的原因是(用化学方程式表示)___________________________,________________________。
④漂白粉是否完全失效可用稀盐酸检验,加稀盐酸后产生的气体是______(填字母代号)。
A.O2 B.Cl2 C.CO2 D.HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4.6g纯净金属钠在干燥的空气中被氧化后,得到7.0g固体,由此可判断其氧化产物是( )
A.只有Na2OB.只有Na2O2C.Na2O和Na2O2D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足表中图示物质在一定条件下能一步转化的组合有
序号 | X | Y | Z | W |
|
① | Cu | CuSO4 | Cu(OH)2 | CuO | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Al | AlCl3 | Al(OH)3 | Al2O3 | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ②③ B. ①③④ C. ①④ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
D. 现代化学分析中,可采用质谱法来确定有机物分子中的官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为______molL-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是______。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400molL-1的稀盐酸。
①该学生需要量取______mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面______。
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水______。
(4)假设该同学成功配制了0.400molL-1的盐酸,他又用该盐酸中和含0.4g NaOH的NaOH溶液,则该同学需取______mL盐酸。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com