
【题目】在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)800 ℃,反应达到平衡时,NO的物质的量浓度是________。

(2)如图中表示NO2的变化的曲线是________。用NO2表示从0~2s内该反应的平均速率v=________。
(3)能说明该反应已达到平衡状态的是________。
a. v(NO2)=2v(O2) b. 容器内压强保持不变
c. 2v逆(NO)=v正(O2) d. 容器内气体的平均摩尔质量保持不变
(4)能使该反应的反应速率增大的是________。
a. 及时分离出NO2气体 b. 适当升高温度
c. 增大O2的浓度 d. 选择高效催化剂
【答案】0.0035 mol/L b 3.0×10-3 mol/(L·s) b、d bcd
【解析】
(1)由表格数据可知,3s后物质的量不再变化,达到平衡状态,结合c=![]() 计算;
计算;
(2)根据一氧化氮物质的量的变化知,该反应向正反应方向移动,则二氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮减少的物质的量等于二氧化氮增加的物质的量;根据v=![]() 计算一氧化氮的反应速率,再结合同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比计算NO2的反应速率;
计算一氧化氮的反应速率,再结合同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比计算NO2的反应速率;
(3)结合平衡的特征分析判断是否为平衡状态;
(4)根据浓度、压强、催化剂等对反应速率的影响分析判断。
(1)由表格数据可知,3s后物质的量不再变化,达到平衡状态,NO的物质的量浓度是![]() =0.0035mol/L,故答案为:0.0035mol/L;
=0.0035mol/L,故答案为:0.0035mol/L;
(2)根据一氧化氮物质的量的变化知,该反应向正反应方向进行,则二氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮减少的物质的量等于二氧化氮增加的物质的量,所以表示NO2的变化的曲线是b,
0~2s内v(NO)= =0.0030mol/(L·s),同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(NO2)= v(NO)=0.003mol/(Ls),故答案为:b;0.003mol/(Ls);
=0.0030mol/(L·s),同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(NO2)= v(NO)=0.003mol/(Ls),故答案为:b;0.003mol/(Ls);
(3)a.v(NO2)=2v(O2)始终存在,不能判定平衡状态,故a不选;b.反应后气体的物质的量逐渐减小,则容器内压强逐渐减小,当压强保持不变,说明达到平衡状态,故b选;c.2v逆(NO)=v正(O2),说明正反应速率大于逆反应速率,不是平衡状态,故c不选;d.容器内气体的质量不变、物质的量逐渐减小,则气体的平均摩尔质量逐渐增大,当气体的平均摩尔质量保持不变,说明达到平衡状态,故d选;故答案为:bd;
(4)a.及时分离出NO2气体,正反应速率减小,故a不选;b.适当升高温度,反应速率增大,故b选;c.增大O2的浓度,反应物浓度增大,反应速率加快,故c选;d.选择高效催化剂,反应速率加快,故d选;故答案为:bcd。


科目:高中化学 来源: 题型:
【题目】在汽车尾气净化装置中,气体在催化剂表面吸附与解吸的过程如图所示。下列说法正确的是

A.N2 是氧化产物
B.NO 和O2 必须在催化剂表面才能反应
C.吸附过程发生化合反应,解吸过程发生分解反应
D.催化转化的总反应为2NO+O2+4CO![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,地球上的碳循环,光合作用是必不可少的(如下图所示)。下列叙述正确的是
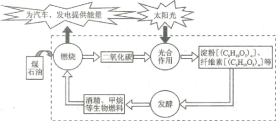
A. 石油与煤是可再生能源
B. CO2是煤、石油形成淀粉、纤维素等的催化剂
C. 光合作用将太阳能转化为化学能
D. 图中所出现的物质中淀粉与纤维素为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氯乙烯是制作装修材料的最常用原料,失火时聚氯乙烯在不同的温度下,发生一系列复杂的化学变化,产生大量有害气体,其过程大体如下:

下列说法不正确的是
A. 聚氯乙烯的单体可由乙烯与HCl加成而得
B. 上述反应中①属于消去反应,④属于(脱氢)氧化反应
C. 火灾中由聚氯乙烯产生的有害气体中含HCl、CO、C6H6等
D. 在火灾现场,可以用湿毛巾捂住口鼻,并弯下腰尽快远离现场
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.A~D是四种烃分子的球棍模型(如图)

(1)与A互为同系物的是___________(填序号)。
(2)能使酸性高锰酸钾溶液褪色的物质是_____________(填序号)。
(3)D和液溴反应的化学方程式是_____________。
Ⅱ. 某些有机物的转化如下图所示。 已知A的产量可以用来衡量一个国家的石油化工水平,D是食醋的有效成分。

请回答下列问题:
(4)A中官能团的名称是______________。
(5)B的结构简式为_________________。
(6)反应③的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)以下四组装置在下列实验可供选择

Ⅰ.实验室用甲醇催化氧化法得到甲醛,并验证甲醛的性质。请回答下列问题:
(1)应选择的装置是___ _____(填写编号)。
(2)若③硬质玻璃管中装有铜粉,请写出硬质玻璃管中发生反应的化学方程式___________________
(3)实验结束后,观察到溴水褪色。为解释这一现象,某学习小组的同学提出两种猜想:
A. 发生了加成反应; B. 发生了氧化反应。
为探究哪种猜想正确,学习小组的同学用pH计测溴水褪色前后溶液的pH,测得溶液的pH下降,你认为发生何种反应,请说出你的理由________________ 。
Ⅱ.若选择①③②验证乙烯与氢气反应产物,请回答下列问题:
(4)写出实验室制乙烯的化学方程式_______________________________________。
(5)NaOH溶液的作用是(答两点即可)____________、_ 。
(6)实验过程中,发现③中溴水褪色,试用化学方程式表示溴水褪色的原因______________;
(7)出现什么现象可说明乙烯与氢气反应生成了乙烷 _____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如下所示。
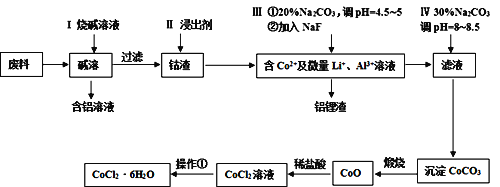
请回答下列问题:
(1)步骤I中主要发生的化学反应方程式为______。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果是_______。
(3)步骤Ⅲ中①的目的是除去Al3+,写出该步反应的离子方程式______。
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有______、______(填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_____、过滤、洗涤、干燥。洗涤过程中可以用工业酒精代替水,其优点是_____。
(6)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是____(填选项,忽略亚钴离子的颜色干扰)
A.KCl B.KSCN C.K2CrO4 D.K2S
已知几种物质在20℃时的颜色及Ksp值如下表
化学式 | AgCl | AgSCN | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 1.0×10-12 | 2.0×10-48 | 2.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1799年由英国化学家汉弗莱·戴维发现一氧化二氮(N2O)气体具有轻微的麻醉作用,而且对心脏、肺等器官无伤害,后被广泛应用于医学手术中。
(1)一氧化二氮早期被用于牙科手术的麻醉,它可由硝酸铵在催化剂下分解制得,该反应的化学方程式为 ___。
(2)已知反应2N2O(g)=2N2(g)+O2(g)的ΔH=–163kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为______kJ。
在的一能定量温为度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:
![]()
①在0~20min时段,反应速率v(N2O)为 ___mol·L-1·min-1。
②若N2O起始浓度c0为0.150mol/L ,则反应至30min时N2O的转化率α=___。
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1 ___T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p= ___(用p0表示)。

(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g) = 2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时NO分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是___(填标号)。
A.温度升高,k值增大 B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大 D.I2浓度与N2O分解速率无关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com