
【题目】对于平衡体系:aA(g)+bB(g)![]() cC(g)+dD(g);正反应放热,有下列判断,其中正确的是( )
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是( )
A.若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.6倍,则a+b<c+d
B.若从正反应开始,A、B的初始物质的量之比为1:1,则平衡时A、B的转化率一定相等
C.若平衡体系中共有气体M mol,再向其中充入b mol B,达到平衡时气体总物质的量为(M+b)mol,则a+b>c+d
D.若从正反应开始,平衡时A、B的转化率相等,则投入A、B物质的量之比为a:b
【答案】D
【解析】
A、温度不变,容器体积扩大一倍,此时A的浓度是原来的0.6倍,说明降低压强,平衡向逆反应移动,降低压强平衡向气体体积增大的方向移动,故a+b>c+d,故A错误;
B、若A、B的初始物质的量之比等于其化学计量数之比,则平衡时A、B的转化率一定相等。A、B的初始物质的量之比为1:1,二者的化学计量数之比不一定是1:1,平衡时转化率不一定相等,故B错误;
C、衡体系中共有气体M mol,再向其中充入bmolB,平衡向正反应移动,达到平衡时气体总物质的量为(M+b)mol,混合气体的总的物质的量不变,故反应前后气体的化学计量数之和相等,即a+b=c+d,故C错误;
D、若从正反应开始,平衡时A、B的转化率相等,则投入A、B的物质的量之比为a:b,即是物质的量之比等于化学计量数之比,故D正确;
故选D.


科目:高中化学 来源: 题型:
【题目】可逆反应N2+3H2![]() 2NH3的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是( )
2NH3的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是( )
A.v正(N2)=v逆(NH3)B.3v正(N2)=v正(H2)
C.2v正(H2)=3v逆(NH3)D.v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) ΔH=-a kJ·mol1(a>0),其反应机理如下
2NOBr(g) ΔH=-a kJ·mol1(a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快
NOBr2(g) 快
②NO(g)+NOBr2(g) ![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 增大Br2(g)浓度能增大活化分子百分数,加快反应速率
D. 正反应的活化能比逆反应的活化能小a kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用只含有铜、铝、铁的工业废料来制备硫酸铜和硫酸铝晶体,实验流程如下:
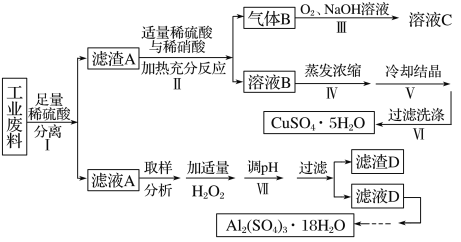
请回答:
(1)写出步骤Ⅲ中气体B与O2(足量)通入NaOH溶液中反应的化学方程式______。
(2)步骤Ⅳ蒸发浓缩的具体操作是________。
(3)下列有关实验说法正确的是________。(填编号)
A.减压过滤使用的滤纸,为确保把所有的孔都覆盖住,应使滤纸大于布氏漏斗内径
B.为得到纯净的硫酸铝晶体,采用加热烘干的方式干燥
C.步骤Ⅵ洗涤沉淀时,关小抽气泵,向布氏漏斗中加冰水没过沉淀,并用玻璃棒搅拌
D.步骤Ⅴ为得到较大的硫酸铜晶体颗粒,可投入几粒晶种并减缓溶液冷却速度
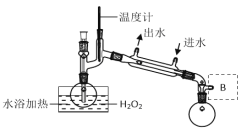
(4)H2O2浓度对反应速率有影响。通过下图所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备,该设备的作用是____。
(5)为测定实验所得硫酸铝晶体的纯度,进行以下实验:
步骤一:取晶体试样a g溶于20 mL水中,加适量醋酸—醋酸铵缓冲溶液,再加入过量的c1mol·L-1EDTA溶液V1mL,充分反应后稀释至250 mL。
步骤二:取25.00 mL上述稀释液,滴加指示剂,用c2mol·L-1ZnCl2溶液滴定过量的EDTA,达到终点时消耗V2mL ZnCl2溶液。
已知:M[Al2(SO4)3·18H2O]=666 g·mol -1,EDTA分别能与Al3+或Zn2+以物质的量之比1∶1进行反应。
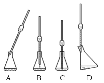
①在步骤二取上述稀释液25.00 mL于锥形瓶中,有下图所示操作(手持部分省略),其中正确的是____。(填编号)取溶液所用仪器的名称是____
②根据实验数据计算该试样中Al2(SO4)3·18H2O的纯度为____(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的镁和铜组成的混合物加入到足量的稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g。下列叙述错误的是
A. 当金属全部溶解时,电子转移的数目为0.3NA
B. 参加反应的金属的总质量3.6g<w<9.6g
C. 当金属全部溶解时,产生的NO气体的体积在标准状况下为2.24L
D. 当生成的沉淀量达到最大时,消耗NaOH溶液的体积为l00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一定量的铁与足量的CuO制单质铜,有人设计了以下两种方案:
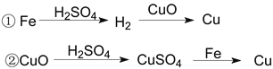
若按实验原则进行操作,则两者制得单质铜的量为 ( )
A.一样多B.①多C.②多D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列实验过程完成后,最终的白色沉淀不一定是BaSO4的是( )
A.Fe(NO3)3溶液![]()
![]()
![]() 白色沉淀
白色沉淀
B.Ba(NO3)2溶液![]()
![]() 白色沉淀
白色沉淀
C.无色溶液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
D.无色溶液![]()
![]() 白色沉淀
白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。
(2)氢能源是最具应用前景的能源之一,高纯氢制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。
①制H2时,连接_______________(填K1或者K2)。产生H2的电极反应式是_____________。
②改变开关连接方式,可得O2,写出制备氧气时电极3对应的电极反应式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为________________________,若将负极材料改为CH4,写出其负极反应方程式_________________________。
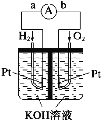
(2)以NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2molL﹣1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为____________________;每消耗3.4g NH3转移的电子数目为_________。
(3)图为青铜器在潮湿环境中因发生电化学反应而被腐蚀的原理示意图。

①腐蚀过程中,负极是_______(填图中字母“a”或“b”或“c”);
②环境中的Cl- 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为______________;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为_______L(标况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com