
 25℃,在20mL 0.1mol?L-1氨水溶液中逐滴加入0.1mol?L-1 HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是( )
25℃,在20mL 0.1mol?L-1氨水溶液中逐滴加入0.1mol?L-1 HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是( )| A、可以选择酚酞作指示剂 |
| B、在C点,V1<10,且有c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| C、在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| D、在D点:c(NH4+)+c(NH3?H2O)═c(Cl-) |


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:

| A、在核电站厂区,较多使用的安全标识是图2 |
| B、在垃圾分类中,废电池属于图4 |
C、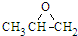 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物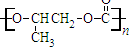 ,反应符合绿色化学的原则 ,反应符合绿色化学的原则 |
| D、图5 装置内发生的反应有化合、分解和置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.8克乙烯和丙烯的混合气体中所含碳原子数为0.2 NA |
| B、0.1mol CnH2n+2含有C-C数为0.1nNA个 |
| C、标准状况下,22.4L CCl4含有NA个CCl4分子 |
| D、1mol苯乙烯含有的C=C数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 俗称 | 干冰 | 石炭酸 | 纯碱 | 硫铁矿 |
| 主要成分 | CO2 | 苯酚 | NaHCO3 | FeS2 |
| 用途 | 做制冷剂 | 制酚醛树脂 | 除油污 | 制硫酸 |
| A | B | C | D |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH溶液中加入铝片:Al+2OH-═AlO2-+H2↑ |
| B、NaHCO3溶液水解:HCO3-+H2O?H3O++CO32- |
| C、NH4HCO3溶液与足量烧碱溶液混合:HCO3-+OH-═CO32-+H2O |
| D、硫酸溶液与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、光导纤维的主要化学成分是SiO2 |
| B、SiO2和CO2都是酸性氧化物,都能与强碱溶液反应 |
| C、SiO2和CO2都能溶于水且与水反应生成相应的酸 |
| D、硅属于非金属,是良好的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 平衡 常数 |
温度 | |
| 973k | 1173k | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |


查看答案和解析>>
科目:高中化学 来源: 题型:

 火力发电厂在发电过程中会释放大量的
火力发电厂在发电过程中会释放大量的
| ||
| 物质 | CO | H2O | HCOOH |
| 浓度/mol?L-1 | 0.5 | 1.5 | 0.5 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com