
【题目】IBr、ICl等称之为卤素互化物,![]() 、
、![]() 、
、![]() 等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
![]() 氯化碘
氯化碘![]() 能与水发生反应:
能与水发生反应:![]() ,该反应_______
,该反应_______![]() 填“是”或“不是”
填“是”或“不是”![]() 氧化还原反应。
氧化还原反应。
![]() 溴化碘
溴化碘![]() 具有强氧化性,能与
具有强氧化性,能与![]() 溶液发生反应,发生反应的离子方程式为___。
溶液发生反应,发生反应的离子方程式为___。
![]() 已知某些离子的还原性强弱顺序为
已知某些离子的还原性强弱顺序为![]() 。现将几滴KSCN溶液滴入到含少量
。现将几滴KSCN溶液滴入到含少量![]() 的溶液中,溶液立即变红,向其中逐滴滴入酸性
的溶液中,溶液立即变红,向其中逐滴滴入酸性![]() 溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象_______________。
溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象_______________。
![]() 下列物质中,也可以使该溶液红色褪去的是 _________。
下列物质中,也可以使该溶液红色褪去的是 _________。
A.新制氯水 ![]() 碘水
碘水 ![]()
![]() 盐酸
盐酸
![]() 为剧毒物质,处理含有KCN的废水常用的方法是:在碱性条件下用NaClO溶液将
为剧毒物质,处理含有KCN的废水常用的方法是:在碱性条件下用NaClO溶液将![]() 氧化为
氧化为![]() 和一种单质气体,该反应的离子方程式为_______________。
和一种单质气体,该反应的离子方程式为_______________。
【答案】![]()
![]() 酸性高锰酸钾将
酸性高锰酸钾将![]() 氧化,减小了
氧化,减小了![]() 的浓度,使
的浓度,使![]() ,平衡不断向左移动,最终
,平衡不断向左移动,最终![]() 完全反应,红色消失
完全反应,红色消失 ![]()
![]()
【解析】
(1)反应中各元素化合价不变,不是氧化还原反应;
![]() 溴化碘
溴化碘![]() 具有强氧化性,能与
具有强氧化性,能与![]() 溶液反应,反应中IBr被还原,亚硫酸钠被氧化;
溶液反应,反应中IBr被还原,亚硫酸钠被氧化;
![]() 根据平衡移动原理分析;
根据平衡移动原理分析;
![]() 能与
能与![]() 或
或![]() 反应的离子可使溶液褪色,其中氯水与
反应的离子可使溶液褪色,其中氯水与![]() 反应,二氧化硫与铁离子反应;
反应,二氧化硫与铁离子反应;
![]() 碱性条件下
碱性条件下![]() 与NaClO反应生成
与NaClO反应生成![]() 、
、![]() 和
和![]() 。
。
![]() 为复分解反应,不是氧化还原反应,
为复分解反应,不是氧化还原反应,
故答案为:不是;
![]() 溴化碘
溴化碘![]() 具有强氧化性,能与
具有强氧化性,能与![]() 溶液反应,反应中IBr被还原,亚硫酸钠被氧化,反应的离子方程式为
溶液反应,反应中IBr被还原,亚硫酸钠被氧化,反应的离子方程式为![]() ,
,
故答案为:![]() ;
;
![]() 溶液中存在
溶液中存在![]() ,高锰酸钾具有强氧化性,可氧化
,高锰酸钾具有强氧化性,可氧化![]() ,则酸性高锰酸钾将
,则酸性高锰酸钾将![]() 氧化,减小了
氧化,减小了![]() 的浓度,使
的浓度,使![]() ,平衡不断向左移动,最终
,平衡不断向左移动,最终![]() 完全反应,红色消失
完全反应,红色消失
故答案为:酸性高锰酸钾将![]() 氧化,减小了
氧化,减小了![]() 的浓度,使
的浓度,使![]() ,平衡不断向左移动,最终
,平衡不断向左移动,最终![]() 完全反应,红色消失;
完全反应,红色消失;
![]() 能与
能与![]() 或
或![]() 反应的离子可使溶液褪色,其中氯水与
反应的离子可使溶液褪色,其中氯水与![]() 反应,二氧化硫与铁离子反应,
反应,二氧化硫与铁离子反应,
故答案为:AC;
![]() 碱性条件下
碱性条件下![]() 与NaClO反应生成
与NaClO反应生成![]() 、
、![]() 和
和![]() ,反应的离子方程式为
,反应的离子方程式为![]() ,
,
故答案为:![]() 。
。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用如下反应,可实现氯的循环利用:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) △H=-115.6 kJ·mol-1
2Cl2(g)+2H2O(g) △H=-115.6 kJ·mol-1

下列说法正确的是
A. 升高温度能提高HCl的转化率
B. 加入催化剂,能使该反运的焓变减小
C. 1molCl2转化为2molCl2原子放出243kJ热量
D. 断裂H2O(g)中1mol H-O键比断裂HCl(g)中1mol H-Cl键所需能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对电子排布式或电子排布图书写的评价正确的是( )
选项 | 电子排布式或电子排布图 | 评价 |
A. | O原子的电子排布图: | 错误;违反泡利不相容原理 |
B. | N原子的电子排布图: | 错误;违反洪特规则 |
C. | Ca原子的电子排布式:1s22s22p63s23p63d2 | 错误;违反能量最低原理 |
D. | Br-的电子排布式:[Ar]3d104s24p6 | 错误;违反能量最低原理 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用KSCN溶液和![]() 溶液探究
溶液探究![]() 的还原性时出现异常现象,实验如下:
的还原性时出现异常现象,实验如下:
|
|
|
|
|
|
溶液变红,大约10秒左右红色褪去,有气体生成 | 溶液变红且不褪色,有气体生成 | 溶液变红且不褪色,滴加盐酸和 |
下列说法不正确的是
A.对比![]() ,可以判定酸性条件下
,可以判定酸性条件下![]() 可以氧化
可以氧化![]()
B.实验![]() 中发生的氧化还原反应有两种
中发生的氧化还原反应有两种
C.![]() 中红色溶液中含有
中红色溶液中含有![]() 胶体
胶体
D.![]() 中发生的氧化还原反应为:
中发生的氧化还原反应为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚磷酸![]() 是二元酸,
是二元酸,![]() 溶液存在电离平衡:
溶液存在电离平衡:![]() 亚磷酸与足量NaOH溶液反应,生成
亚磷酸与足量NaOH溶液反应,生成![]() .
.

![]() 写出亚磷酸与少量NaOH溶液反应的离子方程式 _______________;
写出亚磷酸与少量NaOH溶液反应的离子方程式 _______________;
![]() 某温度下,
某温度下,![]() 的
的![]() 溶液pH的读数为
溶液pH的读数为![]() ,即此时溶液中
,即此时溶液中![]() ,除
,除![]() 之外其他离子的浓度由小到大的顺序是 _____________,该温度下
之外其他离子的浓度由小到大的顺序是 _____________,该温度下![]() 电离平衡的平衡常数
电离平衡的平衡常数![]() ___________。
___________。![]() 第二步电离忽略不计,结果保留两位有效数字
第二步电离忽略不计,结果保留两位有效数字![]()
![]() 向
向![]() 溶液中滴加NaOH溶液至中性,所得溶液中
溶液中滴加NaOH溶液至中性,所得溶液中![]() ___________
___________ ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() .
.
![]() 亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式 _____________;
亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式 _____________;
![]() 电解
电解![]() 溶液也可得到亚磷酸,装置示意图如图:说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
溶液也可得到亚磷酸,装置示意图如图:说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
![]() 阴极的电极反应式为 ________________;
阴极的电极反应式为 ________________;
![]() 产品室中反应的离子方程式为 ______________。
产品室中反应的离子方程式为 ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配平氧化还原反应方程式:____________
________![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]()
(2)称取6.0g含![]() 、
、![]() 和
和![]() 的试样,加水溶解,配成250ml溶液。量取两份此溶液各25.00ml,分别置于两个锥形瓶中。
的试样,加水溶解,配成250ml溶液。量取两份此溶液各25.00ml,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20.00ml时,溶液由无色变为浅红色。该溶液被中和的![]() 的总物质的量为____mol。
的总物质的量为____mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液。
A.![]() 溶液在滴定过程中作_____
溶液在滴定过程中作_____![]() 填“氧化剂”或“还原剂”
填“氧化剂”或“还原剂”![]() ,该滴定过程___
,该滴定过程___![]() 填“需要”或“不需要”
填“需要”或“不需要”![]() 另加指示剂。滴至16.00ml时反应完全,此时溶液颜色由____变为_____。
另加指示剂。滴至16.00ml时反应完全,此时溶液颜色由____变为_____。
B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果____![]() 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响”![]() 。
。
C.若在达到滴定终点时俯视读数,则所得结果_____![]() 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响”![]() 。
。
③原试样中![]() 的质量分数为______,
的质量分数为______,![]() 的质量分数为_____。
的质量分数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列化学方程式或离子方程式:
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___。
(2)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:___。
(3)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 常温下,向20 mL 0.01mol/L CH3COOH溶液中逐滴加入0.01mol/L 的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是
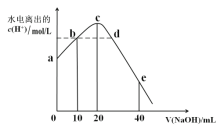
A.从a到c,醋酸的电离始终受到促进
B.a、d对应的纵坐标数值分别是:>10-12、>10-7
C.b点:2c(Na+)=c(CH3COO-)+c(CH3COOH)
D.从b→c的过程中,既存在着pH=7的点,也存在着溶液中水所电离出的c(H+)=10-7的点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铅蓄电池充电时,阳极质量增大
B. 0.1mol ·L-lCH3COONa溶液加热后,溶液的pH减小
C. 标准状况下,11.2L苯中含有的碳原子数为3×6.02×1023
D. 室温下,稀释0.1mol·L-1氨水,c(H+)·c(NH3·H2O)的值减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com