
【题目】某同学用KSCN溶液和![]() 溶液探究
溶液探究![]() 的还原性时出现异常现象,实验如下:
的还原性时出现异常现象,实验如下:
|
|
|
|
|
|
溶液变红,大约10秒左右红色褪去,有气体生成 | 溶液变红且不褪色,有气体生成 | 溶液变红且不褪色,滴加盐酸和 |
下列说法不正确的是
A.对比![]() ,可以判定酸性条件下
,可以判定酸性条件下![]() 可以氧化
可以氧化![]()
B.实验![]() 中发生的氧化还原反应有两种
中发生的氧化还原反应有两种
C.![]() 中红色溶液中含有
中红色溶液中含有![]() 胶体
胶体
D.![]() 中发生的氧化还原反应为:
中发生的氧化还原反应为:![]()
【答案】B
【解析】
![]() 盐酸酸化的氯化亚铁溶液中滴入KSCN溶液,
盐酸酸化的氯化亚铁溶液中滴入KSCN溶液,![]() ,滴入过氧化氢发生氧化还原反应,生成铁离子,形成血红色溶液,大约10秒左右红色褪去,铁离子做催化剂过氧化氢分解有气体生成
,滴入过氧化氢发生氧化还原反应,生成铁离子,形成血红色溶液,大约10秒左右红色褪去,铁离子做催化剂过氧化氢分解有气体生成![]() 经检验为
经检验为![]() ,取褪色后溶液,滴加盐酸和
,取褪色后溶液,滴加盐酸和![]() 溶液,产生白色沉淀为硫酸钡沉淀,证明
溶液,产生白色沉淀为硫酸钡沉淀,证明![]() 离子被氧化为硫酸根离子,
离子被氧化为硫酸根离子,
![]() 盐酸酸化的氯化亚铁溶液中滴入KSCN溶液,
盐酸酸化的氯化亚铁溶液中滴入KSCN溶液,![]() ,滴入过氧化氢溶液,溶液变红且不褪色,说明亚铁离子被氧化为铁离子,铁离子对过氧化氢起到催化剂作用,有气体生成
,滴入过氧化氢溶液,溶液变红且不褪色,说明亚铁离子被氧化为铁离子,铁离子对过氧化氢起到催化剂作用,有气体生成![]() 经检验为
经检验为![]() ,经检验有丁达尔效应,说明生成了氢氧化铁胶体,
,经检验有丁达尔效应,说明生成了氢氧化铁胶体,
![]() 盐酸酸化的氯化亚铁溶液中滴入KSCN溶液,
盐酸酸化的氯化亚铁溶液中滴入KSCN溶液,![]() ,通入足量氧气,溶液变红且不褪色,说明氧气氧化亚铁离子生成铁离子,滴加盐酸和
,通入足量氧气,溶液变红且不褪色,说明氧气氧化亚铁离子生成铁离子,滴加盐酸和![]() 溶液,无白色沉淀,经检验无丁达尔效应,无硫酸钡沉淀生成和氢氧化铁胶体形成,排除了氧气氧化
溶液,无白色沉淀,经检验无丁达尔效应,无硫酸钡沉淀生成和氢氧化铁胶体形成,排除了氧气氧化![]() 的可能。
的可能。
A.对比![]() ,实验
,实验![]() 确定了
确定了![]() 离子被氧化为硫酸根离子,实验
离子被氧化为硫酸根离子,实验![]() 排除了氧气氧化
排除了氧气氧化![]() 的可能,可以判定酸性条件下
的可能,可以判定酸性条件下![]() 可以氧化
可以氧化![]() ,故A正确;
,故A正确;
B.实验![]() 中发生的氧化还原反应有亚铁离子被过氧化氢氧化为铁离子,过氧化氢分解生成氧气,氧气氧化亚铁离子,不止两种,故B错误;
中发生的氧化还原反应有亚铁离子被过氧化氢氧化为铁离子,过氧化氢分解生成氧气,氧气氧化亚铁离子,不止两种,故B错误;
C.![]() 中检验有丁达尔效应,说明红色溶液中含有
中检验有丁达尔效应,说明红色溶液中含有![]() 胶体,故C正确;
胶体,故C正确;
D.![]() 中通入足量氧气溶液变红色说明生成了铁离子,发生的氧化还原反应为:
中通入足量氧气溶液变红色说明生成了铁离子,发生的氧化还原反应为:![]() ,故D正确;
,故D正确;
故选:B。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.pH=l的溶液中:Ba2+、Fe3+、Cl-、SCN-
B.能使酚酞变红的溶液:Ca2+、K+、HCO3-、CO32-
C.![]() =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
D.由水电离的c(H+)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达正确的是( )
A. 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B. 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
C. 基态Fe原子的外围电子排布图为![]()
D. 根据原子核外电子排布的特点,Cu在元素周期表中位于s区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将有机物完全燃烧,生成CO2和H2O,将12 g该有机物完全燃烧产物通过浓硫酸,浓硫酸增重14.4 g,再通过碱石灰,又增重26.4 g。则该有机物的分子式为( )
A. C4H10 B. C2H6O
C. C3H8O D. C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A的相对分子质量为136,分子式为C8H8O2。A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱和核磁共振氢谱如下图。下列关于A的说法中不正确的是

A. 与A属于同类化合物的同分异构体只有4种
B. 符合题中A分子结构特征的有机物只有1种
C. A在一定条件下可与3 molH2发生加成反应
D. A分子属于酯类化合物,在一定条件下能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】IBr、ICl等称之为卤素互化物,![]() 、
、![]() 、
、![]() 等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
![]() 氯化碘
氯化碘![]() 能与水发生反应:
能与水发生反应:![]() ,该反应_______
,该反应_______![]() 填“是”或“不是”
填“是”或“不是”![]() 氧化还原反应。
氧化还原反应。
![]() 溴化碘
溴化碘![]() 具有强氧化性,能与
具有强氧化性,能与![]() 溶液发生反应,发生反应的离子方程式为___。
溶液发生反应,发生反应的离子方程式为___。
![]() 已知某些离子的还原性强弱顺序为
已知某些离子的还原性强弱顺序为![]() 。现将几滴KSCN溶液滴入到含少量
。现将几滴KSCN溶液滴入到含少量![]() 的溶液中,溶液立即变红,向其中逐滴滴入酸性
的溶液中,溶液立即变红,向其中逐滴滴入酸性![]() 溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象_______________。
溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象_______________。
![]() 下列物质中,也可以使该溶液红色褪去的是 _________。
下列物质中,也可以使该溶液红色褪去的是 _________。
A.新制氯水 ![]() 碘水
碘水 ![]()
![]() 盐酸
盐酸
![]() 为剧毒物质,处理含有KCN的废水常用的方法是:在碱性条件下用NaClO溶液将
为剧毒物质,处理含有KCN的废水常用的方法是:在碱性条件下用NaClO溶液将![]() 氧化为
氧化为![]() 和一种单质气体,该反应的离子方程式为_______________。
和一种单质气体,该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与化工生产相关描述不合理的是

A.在合成氨工业中,低温、高压有利于提高合成氨平衡产率
B.在上图海水的综合利用中![]() 均为氧化还原反应
均为氧化还原反应
C.硫酸工业的基本流程:FeS2![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
D.可以采用如下方法制备硅:二氧化硅和适量的炭粉混合,高温反应得到粗硅,利用粗硅和氯气反应,其产物在高温下被氢气还原,从而得到较纯的硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,由弱酸
时,由弱酸![]() 及其盐
及其盐![]() 组成的混合溶液,起始浓度均为
组成的混合溶液,起始浓度均为![]() 。如图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入
。如图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入![]() 或
或![]() 的物质的量而变化的曲线。下列说法中,不正确的是
的物质的量而变化的曲线。下列说法中,不正确的是
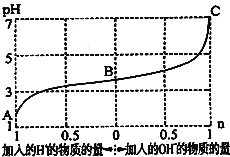
A.A、B、C三点所表示的溶液中水的电离程度依次增大
B.加入1molNaOH后,溶液中![]()
C.通入HCl,![]() 的水解程度增大,HA的电离常数减小
的水解程度增大,HA的电离常数减小
D.未加HCl和NaOH时,溶液中![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com