
【题目】有关下列四个常用电化学装置的叙述中正确的是
A.图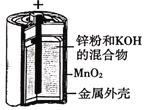 所示电池中,负极电极反应为Zn-2e-=Zn2+
所示电池中,负极电极反应为Zn-2e-=Zn2+
B.图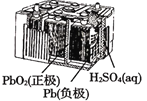 所示电池放电过程中,两电极质量不断增大
所示电池放电过程中,两电极质量不断增大
C.图 所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图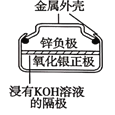 所示电池工作过程中Ag2O被氧化为Ag
所示电池工作过程中Ag2O被氧化为Ag
【答案】B
【解析】
A.该电池反应中由于电解质溶液为碱性,负极的电极反应式为Zn-2e-+2OH-=Zn(OH)2,A错误;
B.铅蓄电池放电时电池反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,负极电极反应式为:Pb-2e-+SO42-=PbSO4↓,正极的电极反应式为:PbO2+2e-+4H++SO42-=PbSO4+2H2O,可见:电池放电过程中,两电极质量不断增大,B正确;
C.粗铜中还含有其它金属,电解时,阳极上粗铜中有铜和其它较活泼金属失电子,阴极纯铜上只有铜离子得电子,阴极上析出的铜大于阳极上减少的铜,所以溶液中铜离子浓度降低,C错误;
D.该原电池中,正极上氧化银得电子生成银,所以Ag2O是氧化剂、发生还原反应,D错误;
故合理选项是B。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的原子结构如下表:
元素符号 | 元素原子结构 |
X | 原子结构示意图为 |
Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为 |
(1)写出X的元素符号:________,元素Y的最简单氢化物的化学式为_________。
(2)Z元素原子的质量数为_______。
(3)X和Z两种元素的最高价氧化物对应的水化物相互反应的离子方程式为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叶蝉散对水稻叶蝉和飞虱具有较强的触杀作用,防效迅速,但残效不长。工业上用邻异丙基苯酚合成叶蝉散的过程如下:
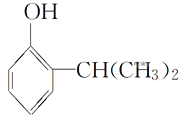 (邻异丙基苯酚)
(邻异丙基苯酚)![]()
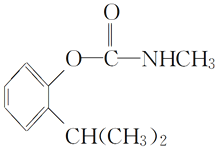 (叶蝉散)
(叶蝉散)
下列有关说法正确的是( )
A.叶蝉散的分子式是C11H16NO2B.邻异丙基苯酚的核磁共振氢谱有7个峰
C.叶蝉散分子中含有羧基D.邻异丙基苯酚与![]() 互为同系物
互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A. 向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B. 向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C. 0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D. 0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成:

下列说法不正确的是
A. Y的分子式为C10H8O3
B. 由X制取Y的过程中可得到乙醇
C. 一定条件下,Y能发生加聚反应和缩聚反应
D. 等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C1O2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得C1O2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是
A. 在反应中H2C2O4既不是氧化剂也不是还原剂
B. 1 mol KClO3参加反应,在标准状况下能得到22.4 L气体
C. 1 mol KClO3参加反应有2 mol电子转移
D. KClO3在反应中是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示(部分夹持装置略)。已知:
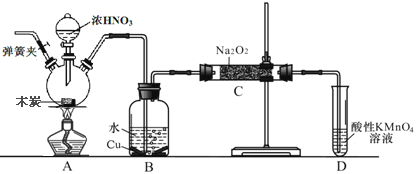
① 3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O
② 酸性条件下,NO与NO2-都能与MnO4-反应生成NO3-和Mn2+;
(1)盛浓硝酸仪器的名称是___________________________。
(2)为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为__________________。
(3)写出NO与Na2O2在常温下生成NaNO2的化学反应方程式__________________;当该反应中转移0.1mole-时,理论上吸收标准状况下NO的体积为_______L。
(4)将11.7g过氧化钠完全转化成亚硝酸钠,理论上至少需要木炭_______g。
(5)NO2易溶于水。将体积为V mL的试管充满NO2后倒扣在水中,见下图。
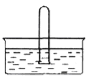
① NO2溶于水的化学方程式是______________________________________。
② 使试管中NO2完全被水吸收的操作是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美宇航局(NASA)提醒人类:环保、素食、节能将有效抑制温室效应;否则两极冰山融化,将引发一系列灾难。美国宇航局(NASA)科研人员发现了一种比二氧化碳高104倍的“超级温室气体”全氟丙烷(C3F8),提醒人们慎用含氟物。有关全氟丙烷的说法正确的是
A. 分子中的三个碳原子可能处于同一直线上
B. 全氟丙烷的电子式为: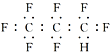
C. 由丙烷转化为全氟丙烷的反应为取代反应
D. 全氟丙烷可由全氟丙烯(CF2=CFCF3)与H2加成得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:①滴加适量H2O2,紫红色褪去,并有气泡产生;②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色; ③最后通入足量的SO2气体。请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________;
(2)实验③中的现象为_____;
(3)实验①中反应的离子方程式是_________________。
(4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为___。
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
Ⅱ.某工业废水中仅含表中的离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
阳离子 | K+、Cu2+、Fe3+、 Al3+、Fe2+ |
阴离子 |
|
甲同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)③中加入少量盐酸生成无色气体的离子方程式是____________________。
(2)将③中红棕色气体(标况下)收集满一试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为___________mol/L(精确到千分位)。
(3)甲同学最终确定原溶液中所含离子是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com