
【题目】已知:_____H2O2 +___Cr2(SO4)3 +_______KOH=________K2CrO4 +________K2SO4 +_______H2O
(1)配平该方程式,并用单线桥法表示电子转移情况。
(2)此反应中氧化剂是__________。
(3)若消耗1molL-1Cr2(SO4)3溶液的体积为50mL,则转移电子的物质的量是______。
【答案】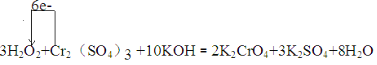 H2O2 0.3mol
H2O2 0.3mol
【解析】
(1)根据氧化还原反应中得失电子数相等配平方程式;
(2)元素化合价降低的反应物做氧化剂被还原;
(3)根据Cr元素的化合价变化计算电子转移的数目。
(1)双氧水中氧元素化合价从-1价降低到-2价,一分子双氧水分子参加氧化还原反应时得2个电子,Cr元素化合价从+3价升高到+6价,一个铬离子参加氧化还原反应失去3个电子,所以得失电子的最小公倍数是6,则双氧水的计量数是3,铬离子的计量数是1,根据原子守恒可知反应的方程式为3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O,用单线桥法表示电子转移情况为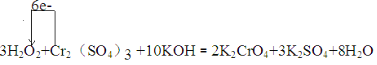 ;
;
(2)元素化合价降低的反应物做氧化剂被还原,其中H2O2中O元素化合价由-1降低到-2,故H2O2是氧化剂;
(3)消耗Cr2(SO4)3的物质的量是1mol/L×0.05L=0.05mol,Cr元素化合价从+3价升高到+6价,所以转移电子的物质的量是0.05mol×2×3=0.3mol。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,将1molM和1molN气体充入2L恒容密闭容器,发生反应M(g)+ N(g)![]() xP(g)+Q(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体P的浓度随时间变化如图所示。
xP(g)+Q(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体P的浓度随时间变化如图所示。
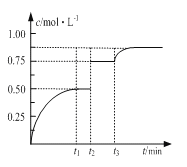
下列说法正确的是
A. 反应方程式中的x=1
B. t2时刻改变的条件是使用催化剂
C. t3时刻改变的条件是移去少量物质Q
D. t1~t3间该反应的平衡常数均为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,物质的量均为0.3mol的X(g)与Y(g)在容积固定的密闭容器中发生反应:X(g)+3Y(g) ![]() 2Z(g),ΔH=-akJ/mol,下列说法正确的是
2Z(g),ΔH=-akJ/mol,下列说法正确的是
A. 反应一段时间后,X与Y的物质的量之比仍为1:1
B. 达到平衡时,反应放出0.1akJ的热量
C. 达到平衡后,若向平衡体系中充入稀有气体,Z的正反应速率将不发生变化
D. X的体积分数保持不变,说明反应已达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《天工开物》中记载:人贱者短褐、枲裳,冬以御寒,夏以蔽体,其质造物之所具也。属草木者,为枲、麻、苘、葛,属禽兽与昆虫者为裘褐、丝绵。各载其半,而裳服充焉矣。文中的“枲、麻、苘、葛”和“裘褐、丝绵”分别属于( )
A. 纤维素、油脂B. 糖类、油脂
C. 纤维素、蛋白质D. 单糖、蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 25°C时,pH=13的1.0L Ba(OH)2溶液中含有的OH数目为0.1NA
B. 一定条件下, SO2与氧气反应生成0.1 mol SO3,反应中转移电子数为0.2NA
C. 7.8g Na2S 和Na2O2的混合物中,含有的阴离子数目为0.1NA
D. 0.1mol丙烯酸中含有双键的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一化工厂以废铁屑为原料制备FeCl3溶液,用作印刷电路铜板腐蚀剂,并对溶液B进行电解处理的实验流程如图:
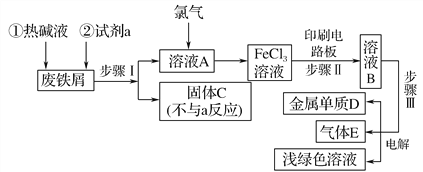
(1)试剂a应选用________(填写名称);
(2)步骤Ⅰ用到的主要玻璃仪器有漏斗、________(填写仪器名称);
(3)写出步骤Ⅱ中主要反应的化学方程式____________________;
(4)实验室制取气体E的离子方程式是________________________,欲对气体E进行干燥和吸收,需选用下列装置中的________(填写序号);
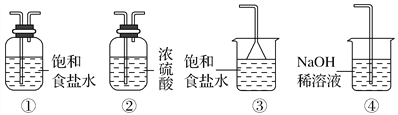
(5)如何用化学方法检验气体E?______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关,下列说法错误的是( )
A.可在水中加入明矾来净化水
B.可在豆浆中加入石膏制作豆腐
C.可用氢氧化铝中和过多胃酸
D.可用二氧化硅作太阳能电池的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的 (不必选其他酸性物质)。请据此回答:
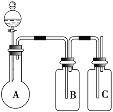
(1)圆底烧瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为______________。
(2)装置B所盛的试剂是_________________,其作用是__________________________。
(3)装置C所盛试剂是___________________,C中反应的离子方程式是_____________________________。
(4)由此可得出的结论是:酸性:__________________>_________________>_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为我国目前的能源消费结构图:
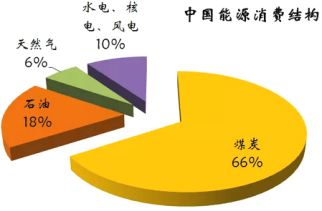
(1)由图中数据可知,一定时期内,我国的能源结构仍以煤碳为主,但直接燃烧煤炭的弊端是_____________________________________________。
(2)将煤转化为水煤气可有效降低煤对环境的破坏性,能量变化如图所示:
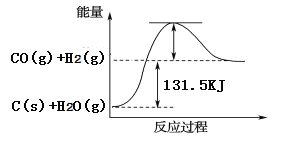
根据以上数据,写出该反应的热化学方程式_____________________________;
(3)直接燃烧水煤气的能量利用率远远低于燃料电池,请写出碱性水煤气燃料电池的负极反应式________________________,______________________。
(4)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用H2、CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度 | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.00 | 2.5 |
③3H2(g)+CO2(g) | K3 | ||
在体积一定的密闭容器中发生反应②,达到平衡后升高温度,下列说法正确的是_______。
A.平衡正向移动 B.达到新的平衡后体系的压强增大
C.H2的转化率增大 D.体系的密度增大
(5)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g) 的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时v正_______ v逆(填“> ”、“= ”或“< ")。
(6)在3L容积可变的密闭容器中发生反应②,已知c(CO)随反应时间t变化曲线I如图所示,若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。

当曲线I变为曲线II时,改变的条件可能是________。当曲线I变为曲线III时,改变的条件可能是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com