
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 25°C时,pH=13的1.0L Ba(OH)2溶液中含有的OH数目为0.1NA
B. 一定条件下, SO2与氧气反应生成0.1 mol SO3,反应中转移电子数为0.2NA
C. 7.8g Na2S 和Na2O2的混合物中,含有的阴离子数目为0.1NA
D. 0.1mol丙烯酸中含有双键的数目为0.1NA
【答案】D
【解析】A、25°C时,pH=13,即c(H+)=10-13mol/L,c(OH-)=![]() mol/L=0.1mol/L,根据n=cV=0.1mol/L×1.0L=0.1mol,个数为0.1NA个,故A正确;B. 一定条件下,SO2与氧气反应时,硫元素的化合价由+4价变成+6价,升高2,生成0.1 mol SO3,反应中转移电子数为0.2NA,故B正确;C.硫化钠和过氧化钠的相对分子质量相等,7.8g硫化钠和过氧化钠混合物的物质的量为0.1mol,由于过氧化钠中阴离子为过氧根离子,则0.1mol混合物中含有0.1mol阴离子,含有的阴离子数为0.1NA,故C正确;D.0.1mol丙烯酸中含有0.1mol碳碳双键、0.1mol碳氧双键,共含有0.2mol双键,含有双键的数目为0.2NA,故D错误;故选D。
mol/L=0.1mol/L,根据n=cV=0.1mol/L×1.0L=0.1mol,个数为0.1NA个,故A正确;B. 一定条件下,SO2与氧气反应时,硫元素的化合价由+4价变成+6价,升高2,生成0.1 mol SO3,反应中转移电子数为0.2NA,故B正确;C.硫化钠和过氧化钠的相对分子质量相等,7.8g硫化钠和过氧化钠混合物的物质的量为0.1mol,由于过氧化钠中阴离子为过氧根离子,则0.1mol混合物中含有0.1mol阴离子,含有的阴离子数为0.1NA,故C正确;D.0.1mol丙烯酸中含有0.1mol碳碳双键、0.1mol碳氧双键,共含有0.2mol双键,含有双键的数目为0.2NA,故D错误;故选D。


科目:高中化学 来源: 题型:
【题目】2-丁烯的结构简式正确的是:
A.CH2=CHCH2CH3 B.CH2=CHCH=CH2
C.CH3CH=CHCH3 D.CH2=C=CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2 mol KMnO4在一定温度下加热后生成a mol O2;将剩余固体与过量浓盐酸混合加热又生成b mol Cl2,此时锰元素均以Mn2+形式存在。若a+b=m,则m的值可能为( )
A. 0.30 B. 0.35
C. 0.40 D. 0.50
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有Fe2+、Al3+、NO3-、NH4+的溶液中先加入过量金属钠,有气体和沉淀生成,然后再加入过量的稀硝酸使沉淀溶解,最终离子数一定不变的是
A.Fe2+B.Al3+C.NO3-D.NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质之间的每步转化中,都能通过一步实现的是( )
①Fe→FeCl2→Fe(OH)2→ Fe(OH)3
②Na→Na2O→Na2CO3→NaHCO3→NaOH
③Mg→MgCl2→Mg(OH)2
④Al→Al2O3→Al(OH)3
⑤Al→NaAlO2→Na2CO3
A. ②③④ B. ①③④⑤ C. ①②③⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:_____H2O2 +___Cr2(SO4)3 +_______KOH=________K2CrO4 +________K2SO4 +_______H2O
(1)配平该方程式,并用单线桥法表示电子转移情况。
(2)此反应中氧化剂是__________。
(3)若消耗1molL-1Cr2(SO4)3溶液的体积为50mL,则转移电子的物质的量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T℃时,向V L的密闭容器中充入一定量的A和B,发生的反应为A(g)+B(g)![]() C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是

A. 前10 min的平均反应速率v(D)=0.3 mol·L-1·min-1
B. 该反应的平衡常数表达式为K=c(C)c2(D)/[c(A)c(B)]
C. 若达到平衡时保持温度不变,压缩容器体积,平衡不移动
D. 反应至15 min时,改变的条件可以是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫元素等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是( )
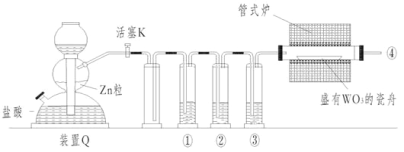
A. 管式炉加热前,用试管在④处收集气体后点燃,通过声音判断气体纯度
B. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com