
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫元素等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是( )
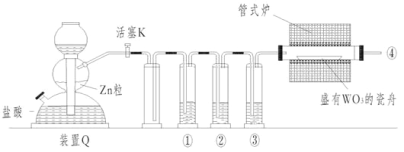
A. 管式炉加热前,用试管在④处收集气体后点燃,通过声音判断气体纯度
B. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 25°C时,pH=13的1.0L Ba(OH)2溶液中含有的OH数目为0.1NA
B. 一定条件下, SO2与氧气反应生成0.1 mol SO3,反应中转移电子数为0.2NA
C. 7.8g Na2S 和Na2O2的混合物中,含有的阴离子数目为0.1NA
D. 0.1mol丙烯酸中含有双键的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向水中通入氯气:Cl2+H2O===2H+ + ClO+ Cl
B. 向Ca(HCO3)2溶液中滴加足量NaOH溶液:Ca2+ + 2HCO3+2OH===CaCO3↓+CO32+2H2O
C. 向明矾溶液中加过量氨水:Al3++4NH3·H2O===AlO2+4NH4++2H2O
D. 将Fe2O3溶解与足量HI溶液:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是
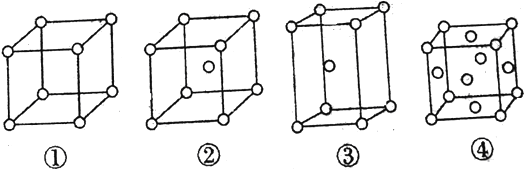
A. ①为简单立方堆积,②为六方最密堆积,③为体心立方堆积,④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为①1个②2个③4个④4个
C. 晶胞中原子的配位数分别为①6 ②8 ③12 ④12
D. 空间利用率的大小关系为①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面关于硅及其化合物的叙述中,不正确的是( )
A.可用氢氟酸在玻璃上雕刻花纹
B.玻璃、陶瓷、水泥都属于传统的硅酸盐产品
C.硅胶可用作食品干燥剂
D.硅元素化学性质不活泼,在自然界中可以游离态形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为我国目前的能源消费结构图:
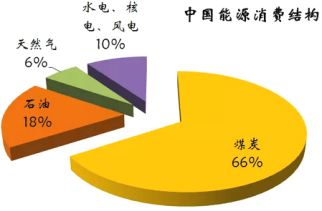
(1)由图中数据可知,一定时期内,我国的能源结构仍以煤碳为主,但直接燃烧煤炭的弊端是_____________________________________________。
(2)将煤转化为水煤气可有效降低煤对环境的破坏性,能量变化如图所示:
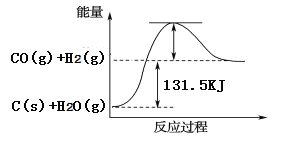
根据以上数据,写出该反应的热化学方程式_____________________________;
(3)直接燃烧水煤气的能量利用率远远低于燃料电池,请写出碱性水煤气燃料电池的负极反应式________________________,______________________。
(4)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用H2、CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度 | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.00 | 2.5 |
③3H2(g)+CO2(g) | K3 | ||
在体积一定的密闭容器中发生反应②,达到平衡后升高温度,下列说法正确的是_______。
A.平衡正向移动 B.达到新的平衡后体系的压强增大
C.H2的转化率增大 D.体系的密度增大
(5)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g) 的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时v正_______ v逆(填“> ”、“= ”或“< ")。
(6)在3L容积可变的密闭容器中发生反应②,已知c(CO)随反应时间t变化曲线I如图所示,若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。

当曲线I变为曲线II时,改变的条件可能是________。当曲线I变为曲线III时,改变的条件可能是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠与水反应的实验过程如图①、②、③所示,下列有关说法不正确的是
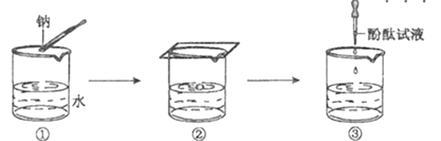
A. 图②中钠熔成小球,说明钠与水反应放热且钠的熔点低
B. 图②中钠四处游动并嘶嘶作响,说明反应产生了气体
C. 图③中滴加酚酞试液后溶液变红,说明有碱性物质生成
D. 钠与水反应的离子方程式是: 2Na+ 2H+=2Na+ + H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一定量的苯的同系物A完全燃烧,生成的气体通过浓硫酸后,浓硫酸增重5.4克,再通过KOH溶液后,KOH溶液增重19.8克,(设浓硫酸和KOH溶液的吸收率为100%)。
(1)通过计算确定A的分子式。(写出计算过程)_________________
(2)若0.1molA的氧化产物(被酸性高锰酸钾氧化)恰好被2mol/L100mL的NaOH溶液完全中和。写出A可能的的结构简式。_________________________
(3)若A的核磁共振氢谱中只有2种峰,则写出A的结构简式。_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】方铅矿的主要成分为PbS,含铅可达86.6%。以方铅矿为原料制备铅蓄电池的电极材料PbO2的工艺流程如图所示:
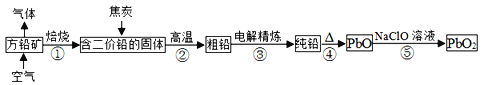
(1)方铅矿焙烧后排出气体的主要成分是______(填化学式),可用于工业制备________。
(2)步骤②中焦炭的作用是________。
(3)“粗铅”的杂质主要有锌、铁、铜、银等。电解精炼时,________作阴极,阴极反应式为________,阳极泥的主要成分是________。
(4)步骤⑤中制备PbO2的离子方程式________。
(5)已知:常温下,Ksp(PbS)=8×10-28、Ka1(H2S)=1.3×10-7、Ka2(H2S)=7.1×10-15。常温下,向Pb(NO3)2溶液中通入H2S气体,发生反应的离子方程式是________;结合数据分析,该反应能否进行得基本完全?________(写出计算推理过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com