
【题目】Ⅰ.下表是A、B两种有机物的有关信息:
A | B |
①分子填充模型为: ②能使溴的四氯化碳溶液褪色; ③其产量是衡量石油化工水平的标志。 | ①由C、H、O三种元素组成,是厨房中的常见调味剂; ②水溶液能使紫色石蕊试液变红。 |
根据表中信息回答下列问题:
(1)关于A的下列说法中,不正确的是____(填标号)。
a.分子里含有碳碳双键 b.分子里所有的原子共平面 c.结构简式为CH2CH2
(2)A与氢气发生加成反应后生成物质C,与C在分子组成和结构上相似的有机物有一大类,它们的通式为CnH2n+2。当n=___时,这类有机物开始出现同分异构体。
(3)B与乙醇反应的化学方程式为___,反应类型为____。
Ⅱ.糖类、油脂和蛋白质是人体需要的重要营养素。
(4)下列说法正确的是____(填标号)。
a.糖类、油脂、蛋白质都是仅由C、H、O三种元素组成的
b.糖类、油脂、蛋白质都是高分子化合物
c.油脂有油和脂肪之分,都属于酯
(5)淀粉和纤维素的化学式都是(C6H10O5)n,它们____(填“是”或“不是”)同分异构体,淀粉水解的最终产物是____(写名称)。
(6)重金属盐能使人体中毒,这是由于它使人体内的蛋白质发生了____(填“盐析”或“变性”)作用。
【答案】c 4 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 酯化反应 c 不是 葡萄糖 变性
CH3COOCH2CH3+H2O 酯化反应 c 不是 葡萄糖 变性
【解析】
根据题意,其产量是衡量石油化工水平的标志是乙烯,由C、H、O三种元素组成,是厨房中的常见调味剂,可能是乙醇或乙酸,水溶液能使紫色石蕊试液变红,只能为乙酸。
⑴根据题意,只有6个原子,能使溴的四氯化碳溶液褪色,其产量是衡量石油化工水平的标志,则为乙烯,乙烯中有碳碳双键,结构简式为CH2=CH2,乙烯中6个原子都在同一平面内。ab错误,c错误,故答案为c;
⑵A与氢气发生加成反应后生成物质乙烷,乙烷为烷烃,甲烷、乙烷、丙烷没有同分异构体,丁烷有正丁烷和异丁烷两种同分异构体,n=4时,就出现同分异构体,故答案为4;
⑶由C、H、O三种元素组成,是厨房中的常见调味剂,可能是乙醇或乙酸,水溶液能使紫色石蕊试液变红,B只能为乙酸。
B与乙醇反应的酯化反应,其化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,反应类型为酯化反应(取代反应),故答案为CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,反应类型为酯化反应(取代反应),故答案为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,酯化反应(取代反应);
CH3COOCH2CH3+H2O,酯化反应(取代反应);
Ⅱ.糖类、油脂和蛋白质是人体需要的重要营养素。
⑷a选项,蛋白质主要由C、H、O、N元素组成,故a错误;
b选项,糖类中淀粉、纤维素,蛋白质是高分子化合物,故b错误;
c选项,油脂有液态的油和固态的脂肪,都属于酯,故c正确;
综上所述,答案为c;
⑸淀粉和纤维素的化学式都是(C6H10O5)n,由于它们的n值不相同,因此不是同分异构体,淀粉水解先生成二糖,二糖再水解生成葡萄糖,故答案为不是;葡萄糖;
⑹重金属盐能使人体中毒,这是使人体内的蛋白质发生变性,这是不可逆的过程,故答案为变性。


科目:高中化学 来源: 题型:
【题目】某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图ⅠⅣ所示。

(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是(填装置序号)___。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为___;与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)___。
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是(填化学式)___。
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应,
①当石灰水过量时,其离子方程式为:___;
②当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为___,请设计实验检验所得溶液中溶质的阴离子___。
(5)已知NaHCO3溶液呈碱性,则在该溶液中c(H2CO3)______c(CO32-),其原因是:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中正确的是
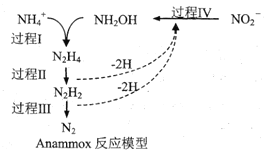
A.1molNH4+所含的质子总数为10NA(设NA为阿伏加德罗常数的值)
B.该方法每处理1molNH4+,需要0.5molNO2-
C.过程IV中,NO2-发生氧化反应
D.N2H2中含有σ键和π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图:

(1)基态Zn2+的价电子排布式为__;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的顺序是__。
(2)甘氨酸(H2N-CH2-COOH)中N的杂化轨道类型为__;甘氨酸易溶于水,试从结构角度解释__。
(3)一水合甘氨酸锌中Zn2+的配位数为__。
(4)[Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为![]() ,则1molIMI中含有__σ键。
,则1molIMI中含有__σ键。
(5)常温下IMI的某种衍生物与甘氨酸形成的离子化合物为液态而非固态,原因是__。

(6)Zn与S形成某种化合物的晶胞如图Ⅰ所示。
①Zn2+填入S2-组成的__空隙中(填“四面体”或“八面体”);
②由图不能判断出S2-、Zn2+相切,若要使S2-、Zn2+相切,则Zn2+半径为__pm,已知晶体密度为dg/cm3,S2-半径为apm。(写计算表达式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组在实验室选用下图所示装置 (夹持装置略)采用镁屑与液溴为原料制备无水MgBr2。
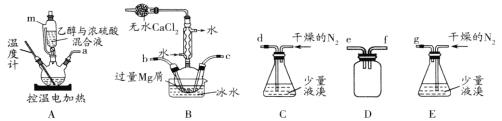
已知:①乙醚的熔点为-116.3℃,沸点为34.6℃。
②Mg和Br2反应非常剧烈,放出大量的热;MgBr2具有强吸水性;MgBr2能与乙醚发生反应 MgBr2 +3C2H5OC2H5![]() MgBr2 3C2H5OC2H5。
MgBr2 3C2H5OC2H5。
③不考虑氮气与镁的反应
实验主要步骤如下:
I.选用上述部分装置,正确连接,检查装置的气密性。向装置中加入药品。
II.加热装置A,迅速升温至140℃,并保持140℃加热一段时间,停止加热。
III.通入干燥的氮气,使溴分子缓慢进入装置B中,直至完全加入。
IV.装置B中反应完毕后恢复至室温,过滤,将滤液转移至干燥的烧瓶中,在冰水中冷却,析出晶体,再过滤得三乙醚合溴化镁粗产品。
V.用苯洗涤粗产品,过滤,得三乙醚合溴化镁,将其加热至160℃分解得无水 MgBr2。
请回答下列问题:
(1)装置A中使用仪器m的优点是_______;
(2)步骤I中所选装置的正确连接顺序是a _____(填小写字母),装置D的作用是____;
(3)若加热装置A一段时间后发现忘记加入碎瓷片,应该采取的正确操作是________;
(4)实验中不能用干燥空气代替干燥N2,原因是___________;
(5)有关步骤V的说法,正确的是____;
A 可用95%的乙醇代替苯溶解粗品 B 洗涤晶体可选用0℃的苯
C 加热至160℃的主要目的是除去苯 D 该步骤的目的是除去乙醚和可能残留的溴
(6)为测定产品的纯度(假定杂质不参与反应),可用EDTA (简写为Y4-,无色)标准溶液滴定,以络黑T为指示剂(pH=6.3~11.6时显蓝色,pH>11.6时显橙色)。已知: Mg2+与络黑T形成的配合物(Mg2+-络黑T)呈酒红色,Mg2+与Y4-形成的MgY2-为无色;在pH约为9的缓冲溶液中滴定,反应的离子方程式为:Mg2+ + Y4-=MgY2-,Mg2+-络黑T+Y4- =MgY2- +络黑T。
①判断滴定终点的现象为____________________;
②测定前,先称取0.2500g无水MgBr2产品,溶解后,加人2滴络黑T试液作指示剂,用0.0500 mol·L-1 EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00 mL,则测得无水MgBr2产品的纯度是___(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用如图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)。
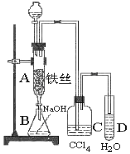
(1)写出A中反应的化学方程式_____。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是____。
(3)C中盛放CCl4的作用是___。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入___,现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室模拟以粗盐(含杂质Mg2+、Ca2+、K+和SO42-)为原料进行生产并综合利用的某过程如下图所示。已知: Kap[Mg(OH)2]=5.6×10-12;Kap[CaMg(CO3)2]<< Kap[Mg(OH)2]。

(1)过量试剂A是_________________________溶液。(填名称)
(2)图为KCI和NaCl的溶解度曲线,连续操作④是_____________________________。

(3)向滤液IV中通入NH3CO2气体后能够得到NaHCO3的原因是_______________(用必要的化学用语和文字说明)。
(4)已知碳酸的Ka2=5.6×10-11,次氯酸的Ka =3×10-8,工业上用饱和纯碱溶液代替烧碱溶液与Cl2反应生产有效成分为次氯酸钠的消毒液,反应的化学方程式是___________________________________。
(5)经检测,滤液Ⅲ中c(Mg2+)<1.0×10-7 mol/L,则镁元素最终沉淀物是_________________。
(6)⑤处母液可以生产氮肥NH4Cl,NH4Cl可用于制取具有漂白作用的三氯化氮。工业上制备NCl3的一种方法是用图所示装置电解,其原理是NH4Cl+2HCl![]() NC13十3H2↑。
NC13十3H2↑。

阳极反应式是___________________________________。
(7)电解氯化钠时需要加入一定量氯化钙,根据学习过的电解知识推测加入氯化钙的主要作用是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现血红色。

(1)物质A的化学式为___,F化学式为___;
(2)B和R在溶液中反应生成F的离子方程式为___;
(3)H在潮湿空气中变成M的实验现象是___,化学方程式为___。
(4)A和水反应生成B和C的离子方程式为___,由此反应可知A有作为___的用途。
(5)M投入盐酸中的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )

A.0.1 mol CuOB.0.1 mol CuCO3
C.0.1 mol Cu(OH)2D.0.05 mol Cu2(OH)2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com