
【题目】已知pOH= -lg c(OH-)。25℃时,向20.00mL 0.10mol/L弱碱MOH溶液中滴加0.10 mol/L盐酸,溶液pH、pOH随滴入盐酸体积的变化如图所示,下列说法正确的是
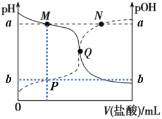
A.Q点消耗盐酸的体积大于20.00mL
B.V(HCl)=40.00mL时,溶液中存在:c(H+) - c(OH-) = c(M+) + 2c(MOH)
C.a+b的值可能大于14
D.水的电离程度:M>Q
【答案】B
【解析】
A. Q点时pH=POH,溶液呈中性,则反应后的溶液为MCl与MOH的混合溶液,从而得出消耗盐酸的体积小于20.00mL,A不正确;
B. V(HCl)=40.00mL时,溶液为MCl与HCl的混合溶液,且二者的浓度相等(不考虑MCl的水解)。在溶液中存在以下两个平衡体系:M++H2O![]() MOH + H+ ,H2O
MOH + H+ ,H2O![]() H++OH-。存在以下两个等量关系:酸电离产生的c(H+)1=c(M+)+c(MOH),M+水解生成的c(H+)2=c(MOH),水电离生成的c(H+)3= c(OH-),从而得出溶液中的c(H+) - c(OH-) = c(M+) + 2c(MOH),B正确;
H++OH-。存在以下两个等量关系:酸电离产生的c(H+)1=c(M+)+c(MOH),M+水解生成的c(H+)2=c(MOH),水电离生成的c(H+)3= c(OH-),从而得出溶液中的c(H+) - c(OH-) = c(M+) + 2c(MOH),B正确;
C.因为溶液的温度为25℃,pH=14,所以a+b=14,C不正确;
D. 在M点时,溶液呈碱性,主要发生碱的电离,水的电离受到抑制,在Q点,溶液呈中性,水的电离不受影响,所以水的电离程度:M<Q,D不正确;
故选B。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,根据如图所示的关系:
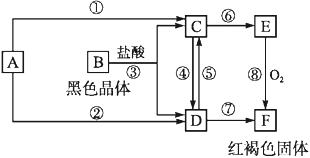
(1)确定C、E的化学式,C为_____,E为_____
(2)写出④的离子方程式,⑧的化学方程式:
④_________________________,
⑧________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在相应的条件下一定能大量共存的是( )
A.在碱性溶液中:HCO3-、K+、Cl-、Na+
B.与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+ 、SO42-
C.在c (H+)/c (OH-)=1×1012的溶液中:NH4+、Ca2+、Cl-、K+
D.在酸性溶液中:K+、CO32-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)N2(g)+2CO2(g),请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-l
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-l
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-l
则2NO(g)+2CO(g)N2(g)+2CO2(g)的△H=____kJ·mol-l。
(2)一定温度下,向体积为 1 L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)=0.1 mol,n(NO)=0.2 mol,n(N2)= a mol,且N2占平衡总体积的![]() 。
。
①则该反应的平衡常数K=______。若保持温度及容器体积不变,平衡后在此基础上再向容器中充入3a mol的N2、0.2 mol的NO,平衡将______移动(填“向左”、“向右”或“不”)。
②下列各种情况,可说明该反应已经达到平衡的是______。
A.v生成(CO2)= v消耗(CO)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.NO、CO、N2、CO2的浓度均不再变化
E.单位时间内生成2n mol碳氧双键的同时消耗n molN≡N
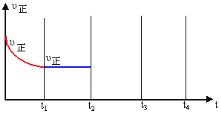
③在t2时刻,将容器迅速压缩到原容积的![]() ,在其它条件不变的情况下, t3时刻达到新的平衡状态。请在图中补充画出t2-t3-t4时段,正反应速率的变化曲线_________。
,在其它条件不变的情况下, t3时刻达到新的平衡状态。请在图中补充画出t2-t3-t4时段,正反应速率的变化曲线_________。
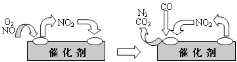
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。写出上述变化中的总化学反应方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是人类生活中不可缺少的物质,海水中含有大量食盐。某地出产的粗盐中,所含杂质是CaCl2,通过下面的实验可制得纯净的NaCl。

请回答:
(1)加入的A是__________,检验A已过量的方法是___________。
(2)加入的B是__________,加入稍过量B的目的是__________。
(3)为检验沉淀是否洗净,最好在最后几滴洗出液中加入_________________溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)![]() 2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
容器1 | 容器2 | 容器3 | |
应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、1mol O2 | 4mol SO3 | 2 mol SO3 |
平衡v正(SO2)/molL-1S-1 | v1 | v2 | v3 |
平衡c(SO3)/molL-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
反应能量变化 | 放出a KJ | 吸收b KJ | 吸收c KJ |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 | K3 |
A. v1< v2,c2<2c1B. K1> K3,p2>2p3
C.v1< v3,α1(SO2 ) <α2(SO3 ) D. c2>2c3,α2(SO3 )+α3(SO2 )<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。则下列说法正确的是( )

A.Mg和Al的总质量为8 g
B.原稀硫酸溶液的物质的量浓度为5 mol·L-1
C.生成的H2在标准状况下的体积为11.2 L
D.NaOH溶液的物质的量浓度为5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物的命名正确的是( )
A.CH3CH(C2H5)CH3 2-甲基丁烷
B.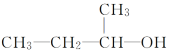 1-甲基-1丙醇
1-甲基-1丙醇
C.CH2BrCH2Br 二溴乙烷
D.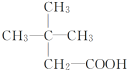 2,2-二甲基丁酸
2,2-二甲基丁酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com