
下列叙述中,正确的是
A.化学反应中物质变化的实质是旧化学键的断裂和新化学键的形成
B.离子化合物中一定有金属元素
C.化学键是物质中原子间强烈的相互作用
D.共价化合物中各原子都一定满足最外层8电子稳定结构
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
目前,我国已经具备了大力推广燃料乙醇的基本条件,部分城市已在汽油中添加燃料乙醇。下列对于乙醇作为燃料的叙述中,错误的是( )
A.乙醇处于半氧化态(耗氧量比汽油少),不需改造发动机便可实现零污染排放
B.使用燃料乙醇可以综合解决国家石油短缺、粮食过剩及环境恶化三大热点问题
C.乙醇的整个生产和消费过程可形成无污染和洁净的闭路循环过程,属可再生能源
D.使用燃料乙醇对抑制“温室效应”意义重大,因此燃料乙醇也属于“清洁燃料”
查看答案和解析>>
科目:高中化学 来源: 题型:
普通干电池两极材料是锌和石墨棒,两极间为MnO2、NH4Cl、ZnCl2糊状物,下列说法错误的是( )
A.干电池中锌作负极,石墨棒作正极
B.负极发生还原反应:Zn-2e-====Zn2+
C.MnO2的作用是把正极附近生成的氢气氧化成水,避免氢气泡出现
D.干电池工作时,由化学能转变为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此精确配制KMnO4标准溶液的操作是:
(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸l h;
(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;
(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处:
(4)利用氧化还原滴定方法,在70℃-80℃条件下用基准试剂(纯度高、稳定性好的物质如:草酸)溶液测定其浓度。
回答下列问题:
(1)为什么要称取稍多于所需的KMnO4固体? 。
(2)通常使用的酸性高锰酸钾溶液,是在高锰酸钾溶液滴入 (填试剂名称)使溶液呈酸性。
(3)若准确称取W g草酸晶体(H2C2O4·2H2O)溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液V mL。
①配制高锰酸钾溶液必须用到的玻璃仪器除了烧杯和玻璃棒外还有
②写出滴定过程中对应的离子方程式
KMnO4溶液的物质的量浓度为________________mol/L;
③若滴定前平视,滴定后俯视,则测得的浓度值将________(填“偏高”或“偏低”)
④达到滴定终点的现象为
查看答案和解析>>
科目:高中化学 来源: 题型:
PH3一种无色剧毒气体,其分子结构和NH3相似,但P—H键键能比N—H键键能低。下列判断错误的是
A.PH3分子呈三角锥形
B.PH3分子是极性分子
C.PH3沸点低于NH3沸点,因为P-H键键能低
D.PH3分子稳定性低于NH3分子,因为N—H键键能高
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是
A.NH4Cl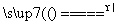 NH3↑+HCl↑
NH3↑+HCl↑
B.NH3+CO2+H2O===NH4HCO3
C.2NaOH+Cl2===NaCl+NaClO+H2O
D.2Na2O2+2CO2===2Na2CO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成气态分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期元素中原子半径最大的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则
(1)B的原子结构示意图为______________________________________;
X的化学名称为________。
(2)B单质的结构式为________;E的气态氢化物的结构式为________;C与D形成的两种化合物中,其中一种物质含有两种类型的化学键,分别为________,该物质属于________(填“离子化合物”或“共价化合物”)。
(3)B、C、E分别与A形成的化合物中最稳定的是____________(写化学式)。
(4)D是同周期简单阳离子中离子半径最________的元素。
(5)F的单质在反应中常作________剂(填“氧化”或“还原”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为________。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是________(填序号)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液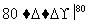 NaClO3溶液
NaClO3溶液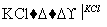 KClO3晶体①完成Ⅰ中反应的总化学方程式:
KClO3晶体①完成Ⅰ中反应的总化学方程式:
 NaCl+
NaCl+ H2O===
H2O=== NaClO3+
NaClO3+ ________。
________。
②Ⅱ中转化的基本反应类型是________________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是____________________________________。
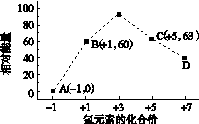
(4)一定条件下,在水溶液中1 mol Cl-、ClO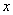 (x=1,2,3,4)的能量(kJ)相对大小如右图所示。
(x=1,2,3,4)的能量(kJ)相对大小如右图所示。
①D是________(填离子符号)。
②B→A+C反应的热化学方程式为________________(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关滴定操作的顺序正确的是( )
①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液
③检查滴定管是否漏水 ④滴定 ⑤洗涤
A.⑤①②③④ B.③⑤①②④ C.③①⑤②④ D.⑤①③②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com