
下列有关滴定操作的顺序正确的是( )
①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液
③检查滴定管是否漏水 ④滴定 ⑤洗涤
A.⑤①②③④ B.③⑤①②④ C.③①⑤②④ D.⑤①③②④
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
下列叙述中,正确的是
A.化学反应中物质变化的实质是旧化学键的断裂和新化学键的形成
B.离子化合物中一定有金属元素
C.化学键是物质中原子间强烈的相互作用
D.共价化合物中各原子都一定满足最外层8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是 (用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为 ,其中存在的化学键类型为 ;
(4)D最高价氧化物的水化物的化学式为 ;
(5)单质D在充足的单质E中燃烧,反应的化学方程式为 ;D在不充足的E中燃烧,生成的主要产物的化学式为 ;
(6)单质E与水反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚铁铵
[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3 mol·L-1 H2SO4溶液,在60 ℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有________(填仪器编号);
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研钵
⑥玻璃棒 ⑦酒精灯
(2)在步骤2中所加的硫酸必须过量,其原因是________________________________________________;
(3)在步骤3中,“一系列操作”依次为____________、__________和过滤;
(4) 本实验制的硫酸亚铁铵晶体常含有Fe3+杂质。检验Fe3+常用的试剂是____________,可以观察到的现象是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃的条件下,将体积都为10 mL,pH都等于3的醋酸和盐酸,加水稀释到a mL和b mL,测得稀释后溶液的pH均为5,则稀释时加入水的体积( )
A.a=b=10 mL B.a=b>10 mL
C.a<b D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系。下列有关物质的推断正确的是( )
A.若甲为焦炭,则丁可能是O2 B.若甲为Fe,则丁可能是Cl2
C.若甲为AlCl3,则丁可能是NH3 D.若甲为NaHCO3,则丁可能是HCl

查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、D、E、G、M代表六种常见元素,它们的核电荷数依次增大。其中,元素M的基态3d轨道上有2个电子,A的基态原子L层电子数是K层电子数的2倍,E的简单离子在同周期元素的简单离子中半径最小,D、G同主族;B与D形成的化合物有多种,其中一种是红棕色气体。
(1)M的基态原子价层电子排布式为___________________________________________,元素B、D、G的第一电离能由大到小的顺序是________________________(用元素符号表示)。
(2)用价层电子对互斥理论预测,GD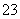 的立体构型是____________(用文字表述)。
的立体构型是____________(用文字表述)。
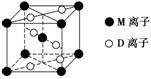
(3)M与D形成的一种橙红色晶体晶胞结构如下图所示,其化学式为________(用元素符号表示)。
(4)已知化合物EB结构与单晶硅相似,该物质可由E的氯化物与NaB3在高温下反应制得,且生成单质B2,该反应化学方程式为_______________________________________________,若有8.4 g B2生成,则转移电子数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
使用胆矾(CuSO4·5H2O)配0.1 mol·L-1的硫酸铜溶液,正确的操作( )
A.将胆矾加热除去结晶水后,称取16 g溶解在1 L水里
B.称取胆矾25 g,溶解在1 L水里
C.将25 g胆矾溶于水,然后将此溶液稀释至1 L
D.将16 g胆矾溶于水,然后将此溶液稀释至1 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com