
����Ŀ����������M��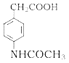 ����һ�ֿ���ʪ�Թؽ���ҩ���ϳ�·����ͼ��
����һ�ֿ���ʪ�Թؽ���ҩ���ϳ�·����ͼ��
���������գ�
��1����Ӧ�ٵķ�Ӧ����Ϊ_____��
��2����Ӧ�����õ��Լ�Ϊ_____��
��3��![]() ������ͬϵ�����ͨ��������Ӧ�Ƶñ���ȩ����д���ڶ�����Ӧ�Ļ�ѧ����ʽ_____������ȩ��ͬ���ͬ���칹����_____�֡�
������ͬϵ�����ͨ��������Ӧ�Ƶñ���ȩ����д���ڶ�����Ӧ�Ļ�ѧ����ʽ_____������ȩ��ͬ���ͬ���칹����_____�֡�
��4��д���ɶ����������ᣨ![]() ���õ������������������Ļ�ѧ����ʽ_____��
���õ������������������Ļ�ѧ����ʽ_____��
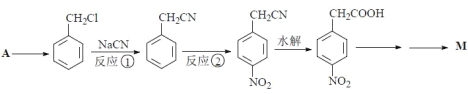
��5��A�ķ���ʽΪC7H8��д����A�ϳ�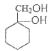 �ĺϳ�·��_____��
�ĺϳ�·��_____��
���ϳ�·�߳��õı�ʾ��ʽΪ��A![]() B����
B����![]() Ŀ����
Ŀ����
���𰸡�ȡ����Ӧ Ũ���ᡢŨ����  3
3 ![]()
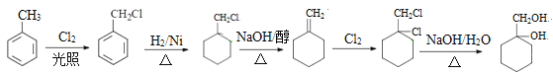
��������
��A![]()
 ���A�ķ���ʽΪC7H8����AΪ
���A�ķ���ʽΪC7H8����AΪ![]() ����������ȡ����Ӧ����Ӧ��������Cl2��ϲ����գ���
����������ȡ����Ӧ����Ӧ��������Cl2��ϲ����գ���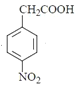
![]() M����֪
M����֪ �ȷ�����ԭ��Ӧ����
�ȷ�����ԭ��Ӧ����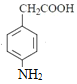 ������CH3COOH����ȡ����Ӧ�����ļ��õ�
������CH3COOH����ȡ����Ӧ�����ļ��õ�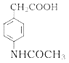 ���ݴ˷������⡣
���ݴ˷������⡣
(1)��Ӧ��Ϊ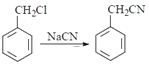 ����Ӧ����Ϊȡ����Ӧ��
����Ӧ����Ϊȡ����Ӧ��
(2)��Ӧ��Ϊ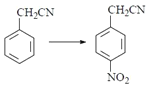 ���DZ���������-NO2������ȡ����Ӧ�����õ��Լ�ΪŨ���ᡢŨ���
���DZ���������-NO2������ȡ����Ӧ�����õ��Լ�ΪŨ���ᡢŨ���
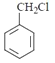
(3)![]() ������ͬϵ�����ͨ��������Ӧ�Ƶñ���ȩ������л���Ϊ
������ͬϵ�����ͨ��������Ӧ�Ƶñ���ȩ������л���Ϊ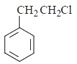 ����ˮ������
����ˮ������ ���ٴ��������ɱ���ȩ�����д�����ʱ������Ӧ�Ļ�ѧ����ʽΪ
���ٴ��������ɱ���ȩ�����д�����ʱ������Ӧ�Ļ�ѧ����ʽΪ ������ȩ��ͬ��ͬ���칹����ָ�����Ϻ���1������1��ȩ������ȡ�������ڡ��䡢��λ�������������3�ַ���������ͬ���칹�壻
������ȩ��ͬ��ͬ���칹����ָ�����Ϻ���1������1��ȩ������ȡ�������ڡ��䡢��λ�������������3�ַ���������ͬ���칹�壻
(4)������������(![]() )���Ҵ�����������Ӧ�õ�������������������������Ӧ�Ļ�ѧ����ʽΪ
)���Ҵ�����������Ӧ�õ�������������������������Ӧ�Ļ�ѧ����ʽΪ![]() ��
��
(5)��A�ϳ� ����A�ķ���ʽΪC7H8�����Ŀ����ﺬ����Ԫ���ṹ����AΪ
����A�ķ���ʽΪC7H8�����Ŀ����ﺬ����Ԫ���ṹ����AΪ![]() ��
�� �к���2�����ǻ���������
�к���2�����ǻ���������![]() ��NaOH��Һ��ˮ��õ���ͬ��
��NaOH��Һ��ˮ��õ���ͬ��![]() ������
������![]() �����ӳɷ�Ӧ�õ����ٽ��
�����ӳɷ�Ӧ�õ����ٽ��![]() ��Cl2�ڹ�����������ȡ����Ӧ����
��Cl2�ڹ�����������ȡ����Ӧ���� �������ϳ�����Ϊ
�������ϳ�����Ϊ ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ӵ���ֳ�Ϊ��ҡ�ڵ�������㷺ʹ���ڵ綯���г��ȣ����ŵ���̾�������ӵ�Ƕ�����Ƕ����(ϰ����������Ƕ�����Ƕ��ʾ�������ò�����Ѳ��ʾ)������ŵ���̾�������������������������˶����γɵ�������װ�ýṹ��ͼ��ͼ��ʾ(���ҺΪ����LiPF6��̼�������ܼ�����ĤΪ�����������ͨ���ĸ߷���Ĥ)������ԭ��ΪC6Li��Li(1��x)MO2![]() LiMO2��C6Li(1��x)(M��������Ԫ��)��������˵���������(����)
LiMO2��C6Li(1��x)(M��������Ԫ��)��������˵���������(����)
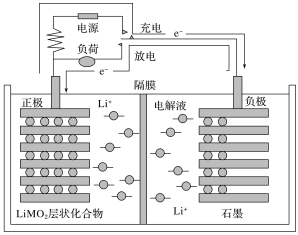
A.��طŵ�ʱ������Ϊʯī
B.����ӵ�ص��ŵ�������С�����������ظ����ʹ��
C.��س��ʱ�����ķ�ӦΪLiMO2��xe��=Li(1��x)MO2��xLi��
D.����ӵ�صĵ��Һ������ˮ��Һ����Ϊ��ǻ��ý���������ˮ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����ڿ��淴ӦN2(g)+3H2(g)![]() 2NH3(g)����N2��H2��NH3����ʼŨ�ȷֱ�ΪC1��C2��C3������Ϊ�㣩������ƽ��ʱ��N2��H2��NH3��Ũ�ȷֱ�Ϊ0.1 mol��L-1��0.3 mol��L-1��0.08 mol��L-1���������ж���ȷ���ǣ� ��
2NH3(g)����N2��H2��NH3����ʼŨ�ȷֱ�ΪC1��C2��C3������Ϊ�㣩������ƽ��ʱ��N2��H2��NH3��Ũ�ȷֱ�Ϊ0.1 mol��L-1��0.3 mol��L-1��0.08 mol��L-1���������ж���ȷ���ǣ� ��
A.C1��C2=1��3
B.ƽ��ʱ��H2��NH3����������֮��Ϊ2��3
C.N2��H2��ת����֮��Ϊ������
D.C1��ȡֵ��ΧΪ0.04 mol��L-1��C1��0.14 mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO��H2��ú�����������������������;�㷺��
��1��CO��ԭ������������Ⱦ��SO2
��2CO��g�� + SO2��g�� ![]() S��s��+2CO2��g�� H = -270 kJ��mol��1���÷�Ӧ��ƽ�ⳣ������ʽΪ__��
S��s��+2CO2��g�� H = -270 kJ��mol��1���÷�Ӧ��ƽ�ⳣ������ʽΪ__��
���ھ��Ⱥ��ݵ��ܱ������н���������Ӧ������˵����ȷ����_____��
a ����������ܶȱ��ֲ��䣬���Ѵ�ƽ��״̬
b ��ƽ������ٳ���һ����CO2��ƽ�ⳣ�����ֲ���
c ���������S�������淴Ӧ���ʾ����ֲ��䣬ƽ�ⲻ�ƶ�
d �ӷ�Ӧ��ʼ��ƽ�⣬�����������ѹǿ���ֲ���
����2 L���º����ܱ�������ͨ��2 mol CO��1 mol SO2���ֱ����a��b��c����ʵ�顣�ڲ�ͬ�������·�����Ӧ��2CO��g�� + SO2��g�� ![]() S��s��+2CO2��g�� H = -270 kJ��mol��1����Ӧ��ϵ��ѹ��ʱ��ı仯���±���ʾ��������ʵ���¶ȵĴ�С��ϵ��_____����a��b��c��ʾ����ʵ��a�ӷ�Ӧ��ʼ��45s�ﵽƽ�⣬��ù��̷�Ӧ����v��SO2��__________���������2λ��Ч���֣���
S��s��+2CO2��g�� H = -270 kJ��mol��1����Ӧ��ϵ��ѹ��ʱ��ı仯���±���ʾ��������ʵ���¶ȵĴ�С��ϵ��_____����a��b��c��ʾ����ʵ��a�ӷ�Ӧ��ʼ��45s�ﵽƽ�⣬��ù��̷�Ӧ����v��SO2��__________���������2λ��Ч���֣���
| 0s | 40s | 45s | 60s |
a | 175 | 142 | 140 | 140 |
b | 160 | 120 | 120 | 120 |
c | 160 | 130 | 125 | 120 |
��2������CO��H2���Ʊ���Ȼ������Ҫ��ӦΪ��
CO��g�� + 3H2��g�� ![]() CH4��g�� + H2O��g�� H1=-206.2 kJ��mol��1��
CH4��g�� + H2O��g�� H1=-206.2 kJ��mol��1��
CO��g�� + H2O��g�� ![]() CO2��g�� + H2��g�� H2 = -41.0 kJ��mol��1��
CO2��g�� + H2��g�� H2 = -41.0 kJ��mol��1��
H2O��l�� �TH2O��g�� H3 =+44 kJ��mol��1 ��
�ش��������⣺
�ٷ�ӦCO2��g�� + 4H2��g�� ![]() CH4��g�� + 2H2O��l�� ��H4 = ________ kJ��mol��1��ij�¶��£��ֱ�����ʼ�ݻ���ͬ�ĺ�ѹ����A����������B�м���1molCO2��4molH2�Ļ�����壬��������Ӧ�ﵽƽ���ų������յ������϶����__�� ����A������B"����
CH4��g�� + 2H2O��l�� ��H4 = ________ kJ��mol��1��ij�¶��£��ֱ�����ʼ�ݻ���ͬ�ĺ�ѹ����A����������B�м���1molCO2��4molH2�Ļ�����壬��������Ӧ�ﵽƽ���ų������յ������϶����__�� ����A������B"����
���ں�ѹ�ܵ���Ӧ���а�n��H2��:n��CO�� = 3:1ͨ��ԭ�������ڴ����������Ʊ��ϳ���Ȼ����400 �� p��Ϊ100 kPaʱ��Ӧ��ϵƽ��������±���ʾ��
��� | CH4 | H2O | H2 | CO2 | CO |
�������/% | 45.0 | 42.5 | 10.0 | 1.50 | 1.00 |
���������CO����ת������=____��![]()
���Ʊ��ϳ���Ȼ��������ԭ������ͨ��ˮ���������������̼��
��̼��ӦΪ����ӦI ��CH4��g�� ![]() C��s�� + 2H2��g�� H = +75 kJ��mol��1��
C��s�� + 2H2��g�� H = +75 kJ��mol��1��
��Ӧ��2CO��g�� ![]() C��s�� + CO2��g�� H = -172 kJ��mol��1��
C��s�� + CO2��g�� H = -172 kJ��mol��1��
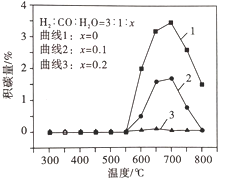
ƽ����ϵ��ˮ����Ũ�ȶԻ�̼����Ӱ����ͼ��ʾ������˵����ȷ����__��
A ����1��700 ~ 800���̼����С��ԭ������Ƿ�Ӧ�������ƶ�
B ����1��550 ~700���̼�������ԭ������Ƿ�ӦI�������������
C ����2��3��550 ~800���̼���ϵ͵�ԭ����ˮ����ϡ������ʹ��̼��Ӧ���ʼ�С
D ˮ���������շ�Ӧ�ų���������������ϵ�¶���550�����£������ڼ��ٻ�̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֦������������о�����ṹ��ʽ������ʾ�����й��ڷ�֦���������ȷ����

A�������к���2�ֹ�����
B�������Ҵ������ᷴӦ���ҷ�Ӧ������ͬ
C��1 mol��֦������к�2mol��OH���ǻ���
D����ʹ������Ȼ�̼��Һ�����Ը��������Һ��ɫ����ԭ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ǻϳ������ص�ԭ�ϣ����������ȩ�ϳɣ�
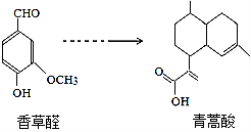
����������ȷ����( )
A�����������C15H14O2
B����һ�����������ȩ����HCHO�������۷�Ӧ
C���������ʷֱ��H2��Ӧ���������H2 ����Ϊ4 mol��3 mol
D������FeCl3��Һ��NaHCO3��Һ���������ȩ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ͷ�չ����Ҫ���ʻ��������ſ�ѧ�����ķ�չ������ʹ�ò��ϵ����ࡢ����������Ҳ���Ų��Ϸ�չ�����������������������Ҳ��֮������̵ı仯����ش��������⣺
��1�����ǽ������ϰ�����ͳ���ǽ������Ϻ��������ǽ������ϣ����������������ǽ������ϵ���__________��ѡ��ĸ���ţ���
a���ϲ��� b������ c���ʯ dʯī e̼-60 f����
��2���Ÿ�����Ŀ���˶�Աʹ�õijŸ˲����Ǹ��ϲ��ϣ����ֲ�����__________����ǿ����������ɣ�������ǿ���������__________��
��3��������ˮ����������;��Ϊ�㷺�IJ��ϣ���ҵ���Ʊ������ֲ���ʹ�õĹ�ͬԭ����__________��
��4��������Ҫ�Ľ������ϣ�������ʯ����Ҫ�ɷ���Fe2O3��ұ��������__________����д��ҵ�����豸���ƣ�����ɵģ����ַ���ұ�������IJ�Ʒ���������ò�Ʒ�����ֵ�ԭ�ϣ����ֵ�ԭ����__________��
��5���ϳɸ߷��Ӳ��ϵ�С���ӽ�__________��ij����ϩ�������ϳ�4.2��103kg�ľ���ϩ������ҪͶ�ϣ���ϩ��__________ mol�������跴Ӧ���̲�������ʧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20.00 mL 0.1000 mol��L1�����еμ�0.1000 mol��L1 NaOH��Һ����Һ��pH��NaOH��Һ����ı仯��ͼ����֪lg3=0.5������˵������ȷ����
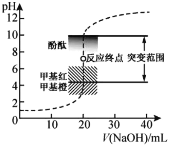
A.ѡ���ɫ��Χ��pHͻ�䷶Χ�ڵ�ָʾ�����ɼ�Сʵ�����
B.����Һ����ȡ20.00 mL 0.1000 mol��L1����ʱ����Һ��ˮϴ�����ô�ȡҺ��ϴ
C.NaOH����ҺŨ�ȵ�ȷ��ֱ��Ӱ���������Ŀɿ��ԣ���������ڱ���������ر궨NaOH��Һ��Ũ�ȣ��궨ʱ���ü���Ϊָʾ��
D.V(NaOH)=10.00 mL ʱ��pHԼΪ1.5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ�����У�������̼�����ơ��Ȼ��ơ��Ȼ�淋������ܽ�ȵIJ��죬ͨ������ʳ��ˮ�����Ͷ�����̼��Ӧ�����̼�����ƾ��壬��Ӧԭ���������»�ѧ����ʽ��ʾ��NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3�������ݴ�ԭ�������Ƶ�̼�����ƾ��壬ijУѧ���������ʵ��װ�ã�����Bװ���е��Թ��������а����Ȼ��Ƶ���Һ���Ҷ��߾��Ѵﵽ���ͣ�
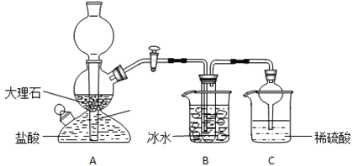
(1)Aװ������������Ӧ�����ӷ���ʽΪ��_________________��Cװ����ϡ���������Ϊ��________________��
(2)�±������г�������������ڲ�ͬ�¶��µ��ܽ�����ݣ�g/100gˮ��
0�� | 10�� | 20�� | 30�� | 40�� | 50�� | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
���ձ������ݣ������Bװ����ʹ�ñ�ˮ����Ϊ________________��
(3)��Уѧ���ڼ�������װ�������Ժ����ʵ�飬���û�еõ�̼�����ƾ��壬ָ����ʦָ��Ӧ�� ______װ��____֮�䣨��д��ĸ������һ��ʢ��_________ ��ϴ��װ�ã���������___________
(4)���øĽ����װ�ý���ʵ�飬��B�е��Թ��������˾��壬����Ҫ�IJ�����õ���һ�ִ����ľ��塣��ͨ����ʵ���жϸþ�����̼�����ƾ��������̼����茶��壬��������������ʵ�������ۣ�______________��
(5)����Уѧ������ʵ��ʱ�����ñ���ʳ��ˮ�к�NaCl������Ϊ5.85g��ʵ���õ������NaHCO3���������Ϊ5.88g����NaHCO3�IJ���Ϊ__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com