
【题目】CO、H2是煤的气化产物,在生产生活中用途广泛。
(1)CO还原法处理大气污染物SO2
①2CO(g) + SO2(g) ![]() S(s)+2CO2(g) H = -270 kJ·mol-1,该反应的平衡常数表达式为__。
S(s)+2CO2(g) H = -270 kJ·mol-1,该反应的平衡常数表达式为__。
②在绝热恒容的密闭容器中进行上述反应,下列说法正确的是_____。
a 若混合气体密度保持不变,则已达平衡状态
b 达平衡后若再充人一定量CO2,平衡常数保持不变
c 分离出部分S,正、逆反应速率均保持不变,平衡不移动
d 从反应开始到平衡,容器内气体的压强保持不变
③向2 L恒温恒容密闭容器中通人2 mol CO、1 mol SO2,分别进行a、b、c三组实验。在不同催化剂件下发生反应:2CO(g) + SO2(g) ![]() S(s)+2CO2(g) H = -270 kJ·mol-1,反应体系总压随时间的变化如下表所示,则三组实验温度的大小关系是_____(用a、b、c表示),实验a从反应开始至45s达到平衡,则该过程反应速率v(SO2)__________(结果保留2位有效数字)。
S(s)+2CO2(g) H = -270 kJ·mol-1,反应体系总压随时间的变化如下表所示,则三组实验温度的大小关系是_____(用a、b、c表示),实验a从反应开始至45s达到平衡,则该过程反应速率v(SO2)__________(结果保留2位有效数字)。
| 0s | 40s | 45s | 60s |
a | 175 | 142 | 140 | 140 |
b | 160 | 120 | 120 | 120 |
c | 160 | 130 | 125 | 120 |
(2)利用CO、H2可制备天然气,主要反应为:
CO(g) + 3H2(g) ![]() CH4(g) + H2O(g) H1=-206.2 kJ·mol-1;
CH4(g) + H2O(g) H1=-206.2 kJ·mol-1;
CO(g) + H2O(g) ![]() CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
H2O(l) ═H2O(g) H3 =+44 kJ·mol-1 。
回答下列问题:
①反应CO2(g) + 4H2(g) ![]() CH4(g) + 2H2O(l) 的H4 = ________ kJ·mol-1。某温度下,分别在起始容积相同的恒压容器A、恒容容器B中加人1molCO2和4molH2的混合气体,两容器反应达到平衡后放出或吸收的热量较多的是__( 填“A”或“B")。
CH4(g) + 2H2O(l) 的H4 = ________ kJ·mol-1。某温度下,分别在起始容积相同的恒压容器A、恒容容器B中加人1molCO2和4molH2的混合气体,两容器反应达到平衡后放出或吸收的热量较多的是__( 填“A”或“B")。
②在恒压管道反应器中按n(H2):n(CO) = 3:1通入原料气,在催化剂作用下制备合成天然气,400 ℃ p总为100 kPa时反应体系平衡组成如下表所示:
组分 | CH4 | H2O | H2 | CO2 | CO |
体积分数/% | 45.0 | 42.5 | 10.0 | 1.50 | 1.00 |
则该条件下CO的总转化率α=____。![]()
③制备合成天然气采用在原料气中通入水蒸气来缓解催化剂积碳。
积碳反应为:反应I :CH4(g) ![]() C(s) + 2H2(g) H = +75 kJ·mol-1;
C(s) + 2H2(g) H = +75 kJ·mol-1;
反应Ⅱ:2CO(g) ![]() C(s) + CO2(g) H = -172 kJ·mol-1,
C(s) + CO2(g) H = -172 kJ·mol-1,
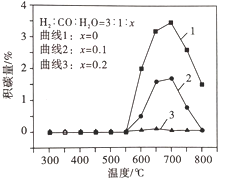
平衡体系中水蒸气浓度对积碳量的影响如图所示,下列说法正确的是__。
A 曲线1在700 ~ 800℃积碳量减小的原因可能是反应Ⅱ逆向移动
B 曲线1在550 ~700℃积碳量增大的原因可能是反应I、Ⅱ的速率增大
C 曲线2、3在550 ~800℃积碳量较低的原因是水蒸气稀释作用使积碳反应速率减小
D 水蒸气能吸收反应放出的热量,降低体系温度至550℃以下,有利于减少积碳
【答案】![]() a c a>b=c 0.0067 mol/(L·s) -253.2 A 97.9% AD
a c a>b=c 0.0067 mol/(L·s) -253.2 A 97.9% AD
【解析】
(1) ①平衡常数直接根据表达式得出答案;②气相为主的反应中,固相物质的浓度项不列入反应的平衡常数表达式,结合常用判断化学平衡的方法判断化学反应是否达到平衡,据此逐项分析;③理想气体状态方程PV=nRT,结合表格数据,可以比较出温度大小;计算反应速率,要计算出过程中SO2的消耗量即可。
(2) ①①CO(g) + 3H2(g) ![]() CH4(g) + H2O(g) H1=-206.2 kJ·mol-1;
CH4(g) + H2O(g) H1=-206.2 kJ·mol-1;
②CO(g) + H2O(g) ![]() CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
③H2O(l) ═H2O(g) H3 =+44 kJ·mol-1 。
将方程式①-②-2x③得CO2(g) + 4H2(g) ![]() CH4(g) + 2H2O(l),△H进行相应的改变;A为恒温恒压、B为恒温恒容条件,如果是恒温恒容,反应前后物质的量减小、压强减小,开始时AB压强相等,B中压强逐渐减小A中压强不变,所以反应过程中压强A>B,增大压强平衡正向移动。
CH4(g) + 2H2O(l),△H进行相应的改变;A为恒温恒压、B为恒温恒容条件,如果是恒温恒容,反应前后物质的量减小、压强减小,开始时AB压强相等,B中压强逐渐减小A中压强不变,所以反应过程中压强A>B,增大压强平衡正向移动。
②设n(H2)=3mol、n(CO)=1mol,恒容恒温条件下气体的体积分数之比等于物质的量分数之比,设平衡时混合气体总物质的量为x mol,根据C原子守恒得![]() ,得x=2.11,则CO的转化率=
,得x=2.11,则CO的转化率=![]() ,该反应的正反应是放热反应,升高温度平衡逆向移动;
,该反应的正反应是放热反应,升高温度平衡逆向移动;
③A.反应II的逆反应是消碳反应;B.反应I、II的正反应都是积碳反应;C.高温条件下水蒸气和C反应生成CO和氢气;D.温度至550℃以下,几乎没有积碳。
(1) ①平衡常数表达式![]() ,故答案为:
,故答案为:![]() ;
;
②绝热恒容的密闭容器进行可以反应,
a. 混合气体密度为ρ=m/v,恒容容器容积V不变,反应前后气体的质量发生改变,则当反应到达平衡时,气体总质量m不变,因此若混合气体密度保持不变可以说明反应已经达到平衡状态,可知a正确;
b. 充人一定量CO2,反应移向移动,吸热,容器绝热,温度降低,平衡常数保持变化,b错误;
c.固体不影响平衡反应进行,故都不变,c正确;
d. 反应达到平衡前后,气体总物质的量发生改变,则体系压强改变,d错误;
ac正确,故答案为:a c;
③体系c和体系b反应起始时和平衡时的压强都相等,则二者平衡常数相同,体系c和体系b的温度相等,根据理想气体状态方程![]() ,初始时刻压强a>b,则实验温度a>b,因此三组实验温度的关系是a>b=c,故答案为:a>b=c;
,初始时刻压强a>b,则实验温度a>b,因此三组实验温度的关系是a>b=c,故答案为:a>b=c;
实验a从反应开始至平衡时,压强由175kPa改变至140kPa,设反应过程转化了xmol SO2,由理想气体状态方程可知,压强与气体总物质的量成正比,所以有![]() ,解得x=0.6mol,则反应速率
,解得x=0.6mol,则反应速率![]() ,故答案为:0.0067 mol/(L·s);
,故答案为:0.0067 mol/(L·s);
(2) ①①CO(g) + 3H2(g) ![]() CH4(g + H2O(g) H1=-206.2 kJ·mol-1;
CH4(g + H2O(g) H1=-206.2 kJ·mol-1;
②CO(g) + H2O(g) ![]() CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
③H2O(l) ═H2O(g) H3 =+44 kJ·mol-1 。
将方程式①-②-2x③得CO2(g) + 4H2(g) ![]() CH4(g) + 2H2O(l),△H=-253.2 kJ·mol-1,;A为恒温恒压、B为恒温恒容条件,如果是恒温恒容,反应前后物质的量减小、压强减小,开始时AB压强相等,B中压强逐渐减小A中压强不变,所以反应过程中压强A>B,增大压强平衡正向移动,故答案为:-253.2;A;
CH4(g) + 2H2O(l),△H=-253.2 kJ·mol-1,;A为恒温恒压、B为恒温恒容条件,如果是恒温恒容,反应前后物质的量减小、压强减小,开始时AB压强相等,B中压强逐渐减小A中压强不变,所以反应过程中压强A>B,增大压强平衡正向移动,故答案为:-253.2;A;
②设n(H2)=3mol、n(CO)=1mol,恒容恒温条件下气体的体积分数之比等于物质的量分数之比,设平衡时混合气体总物质的量为x mol,根据C原子守恒得![]() ,得x=2.11,则CO的转化率=
,得x=2.11,则CO的转化率=![]() ,该反应的正反应是放热反应,升高温度平衡逆向移动;
,该反应的正反应是放热反应,升高温度平衡逆向移动;
③A.反应II的逆反应是消碳反应,曲线1在700-800℃积碳量减小的原因可能是反应Ⅱ逆向移动,且反应II的消碳量大于反应I的积碳量,故A正确;
B.反应I、II的正反应都是积碳反应,曲线1在550-700℃时两个反应没有达到平衡状态,都向正反应方向移动,导致积碳量增加,故B错误;
C.高温条件下水蒸气和C反应生成CO和氢气,从而使积碳量减少,故C错误;
D.温度至550℃以下,几乎没有积碳,所以水蒸气能吸收反应放出的热量,降低体系温度至550℃以下,有利于减少积碳,故D正确;
故选AD。


科目:高中化学 来源: 题型:
【题目】已知X、M都是中学教材常见元素,下列对两个离子反应通式的推断中,其中正确的是
(甲)![]() +Xn-
+Xn-![]() ——X单质
——X单质![]() 未配平); (乙
未配平); (乙![]() mOH-===M(OH)m
mOH-===M(OH)m![]()
①若n=1,则![]() 中X元素为+5价,X位于周期表第ⅤA族
中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧![]() 溶液一定能得到
溶液一定能得到![]()
⑤若m=3,则![]() 与足量氢氧化钠溶液反应一定生成M(OH)m
与足量氢氧化钠溶液反应一定生成M(OH)m
A.①③B.④⑤C.①②D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家罗伯特莱夫科维茨和布莱恩克比尔卡因“G 蛋白偶联受体研究”而获得2012年诺贝尔化学奖,他们将碘的同位素附着到各种激素上,借助放射学找到一些受体,进一步研究出“G 蛋白偶联受体”发挥的作用和机理,下列有关说法正确的是( )
A.放射性同位素![]() I 原子核内中子数与质子数的差为 78
I 原子核内中子数与质子数的差为 78
B.蛋白质是生物体维持生命活动所需能量的主要来源
C.动物蛋白质和植物蛋白质混合摄入,更能增强蛋白质的营养作用
D.“春蚕到死丝方尽,蜡烛成灰泪始干”其中的“丝”和“泪”化学成分都是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图装置中发生反应的离子方程式为:Zn+2H+=Zn2++H2↑,下列说法错误的是
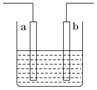
A. a、b不可能是同种材料的电极
B. 该装置可能是电解池,电解质溶液为稀盐酸
C. 该装置可能是原电池,电解质溶液为稀盐酸
D. 该装置可看作是铜-锌原电池,电解质溶液是稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)糖类、油脂、蛋白质和维生素都是人类的基本营养物质,下表为某品牌燕麦片标签中的一部分。

该燕麦片的营养成分中,能与水反应生成氨基酸的营养物质是_________,每克营养物质氧化时放出能量最多的是_________,一般营养、健康类杂志中提到的“碳水化合物”是指_________,人体必需的微量元素是_________;
(2)维生素C易溶于水,向其水溶液中滴入紫色石蕊试液,石蕊变红色,加热该溶液至沸腾,红色消失,因此,烹调富含维生素C的食物时,应该注意_________;在碱性条件下,维生素C易被空气氧化,烧煮时最好加一点_________;
(3)我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等.用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:

则羊毛的编号为_________,棉花的编号为_________,涤纶的编号为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
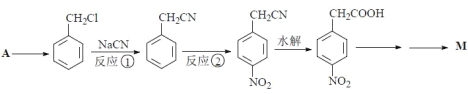
【题目】阿克他利M(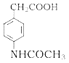 )是一种抗风湿性关节炎药物,其合成路线如图:
)是一种抗风湿性关节炎药物,其合成路线如图:
完成下列填空:
(1)反应①的反应类型为_____。
(2)反应②所用的试剂为_____。
(3)![]() 的相邻同系物可以通过两步反应制得苯乙醛。请写出第二步反应的化学方程式_____。苯乙醛的同类别同分异构体有_____种。
的相邻同系物可以通过两步反应制得苯乙醛。请写出第二步反应的化学方程式_____。苯乙醛的同类别同分异构体有_____种。
(4)写出由对硝基苯乙酸(![]() )得到对硝基苯乙酸乙酯的化学方程式_____。
)得到对硝基苯乙酸乙酯的化学方程式_____。
(5)A的分子式为C7H8,写出由A合成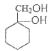 的合成路线_____。
的合成路线_____。
(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO不仅是家用煤气的主要成分,也是重要的化工原料。工业上用简单有机物合成高分子涂料黏胶剂I的过程如下:
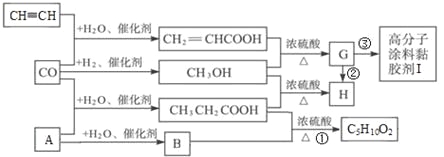
请回答下列问题:
(1)A的结构式_____。
(2)G分子中官能团名称是_____。
(3)写出反应①的化学方程式_____,指出②的反应类型_____。
(4)写出反应③的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
 △H=+88.6kJ/mol
△H=+88.6kJ/mol
则M与N相比,较稳定的是____。
(2)已知CH3OH⑴的燃烧热为726.5kJ·mol-1,CH3OH(l) + l/2O2(g)=CO2(g)+2H2(g)
△H=-akJ·mol-1,则a_______726.5 (填“>”、“<”或 “=”)
(3)将Cl2和H2O(g)通过灼热的木炭层,生成HCl和CO2。当有1mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:______________________ 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料, 4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) △H=-1176kJ·mol-1,则27g铝粉完全反应放出的热量为_____________。
(5)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+489.0 kJ mol-1
CO(g)+l/2O2(g)=CO2(g) △H=-283. 0kJ mol-1
C (石墨)+O2(g)=CO2(g) △H=-393.5kJ mol-1
则4Fe (s)+3O2(g) =2Fe2O3 (s) △H=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com