
【题目】当镁原子由1s22s22p63s2 →1s22s22p63p2时,以下认识正确的是( )
A. 镁原子由基态转化成激发态,这一过程中吸收能量
B. 镁原子由激发态转化成基态,这一过程中释放能量
C. 转化后位于p能级上的两个电子处于同一轨道,且自旋方向相同
D. 转化后镁原子与硅原子电子层结构相同,化学性质相似
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和Y各3 mol充入10 L恒容密闭容器中,发生反应:3X(g)+Y(g)![]() 2Z(g)+ W(g)。经过8min,反应达到平衡状态,此时Z的物质的量为1.6 mol。下列关于反应开始至第8 min时的平均反应速率的计算正确的是
2Z(g)+ W(g)。经过8min,反应达到平衡状态,此时Z的物质的量为1.6 mol。下列关于反应开始至第8 min时的平均反应速率的计算正确的是
A. v(X)=0.30 mol/(L·min) B. v(Y)=0.02 mol/(L·min)
C. v(Z)=0.02 mol/(L·min) D. v(W)=0.10 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加徳罗常数的值,下列说法不正确的是( )
A. 9.2g NO2和N2O4的混合物中含氮原子数目为0.2NA
B. 常温常压下,35.5g Cl2与足量的NaOH溶液完全反应,转移的电子数为0.5NA
C. 标准状况下,2.24LNH3与1.6gCH4分子中所含电子数目均为NA
D. 已知反应N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ mol-1,当生成NA个NH3分子时,反应放出的热量小于46.2kJ
2NH3(g)△H=-92.4kJ mol-1,当生成NA个NH3分子时,反应放出的热量小于46.2kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式书写正确的是
A.FeCl2溶液中通入Cl2:Fe2+ +Cl2 === Fe3+ + 2Cl-
B.实验室用固体氯化铵和熟石灰共热制取NH3:
2NH4++Ca(OH)2 === 2NH3↑+ Ca2++H2O
C.FeO与稀HNO3反应:3FeO + 10H+ + NO3- === 3Fe3+ + NO↑+5H2O
D.实验室用石灰石制CO2:CO32- + 2H+ === CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧、硫、硒、碲等氧族元素在化合物中常表现出多种氧化态,含氧族元素的化合物在研究和生产中有许多重要用途。请回答以下问题:
(1)氧、硫、硒三元素的第一电离能由大到小的顺序为_______________________(用元素符号回答)。
(2)基态Se原子的价层电子排布式为___________,其原子核外有______________种运动状态不同的电子。
(3)气态SO3为单分子状态,其中S原子的杂化轨道类型为________。若SO3的三聚体(SO3)3的环状结构如图所示,则该结构中S原子的杂化轨道类型为____________________。
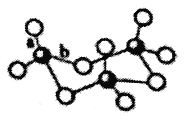
(4)氧族元素的气态氢化物中,H2S的稳定性强于H2Se,原因是________________________________。
(5)氧、硫分别与钙形成两种化合物的晶格能大小为 CaO __________CaS (填“>”,“<”或“=”)。 (6)硫化锌在光导材料、涂料等行业中应用广泛,其晶体结构如图,则该晶体属于________晶体,化学式为__________,若晶体的密度为ρg·cm-3,则晶胞边长为____________cm (阿伏加德罗常数的值用NA表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要1.84mol/L的稀硫酸480mL,现用98%的浓硫酸(密度为1.84g/cm3)配成,请按要求填空:
(1)该实验所需浓硫酸的体积为__________mL
(2)该实验用到的主要仪器有:量筒、烧杯、玻璃、胶头滴管、______________。
(3)配制过程中,将误差结果用“偏高”,“偏低”,“无影响”填入下列空格:
①配制溶液的过程中,没有洗涤烧杯和玻璃杯,所配溶液浓度将____________
②如果定容过程中,俯视刻度线,所配溶液浓度将___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 60g水晶晶体中,含有“Si—O”键的数目为2NA
B. 14g氮气含有![]() 键的数目为2NA
键的数目为2NA
C. 18g冰中含有的氢键数目为2NA
D. 12g金刚石中含有C—C键的数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应都有水参加,其中属于氧化还原反应,而水既不做氧化剂,又不做还原剂的是
A.2F2+2H2O=4HF+O2 B.2Na+2H2O=2NaOH+H2↑
C.C12+H2O=HC1O+HC1 D.C+H2O![]() CO+H2
CO+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室抽取纯净而干燥的氯气(Cl2)的实验装置图

(1)“气体发生装置”中的反应原理如下,请用双线桥法表示出电子转移的方向和数目:
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O _______________________
MnCl2+Cl2↑+2H2O _______________________
(2)当反应消耗174g MnO2时,生成的Cl2数目为___。
(3)浓硫酸的作用是:_______________________。
(4)请指出上图中一处非常明显的错误(不考虑“尾气吸收装置”可能发生倒吸,及“尾气吸收装置”中水蒸气进入“气体收集装置”)_______________________;
(5)改正错误后,进行实验。请将如下实验步骤按正确撮作顺序排序__________________。
①打开分液漏斗,向烧瓶中加入一定量的浓盐酸
②捡验收集装置内已集满氯气
③连接实验装置
④结束实验
⑤装入药品
⑥点燃酒精灯
⑦检查装置气密性
(6)已知“尾气吸收装置”中反应的氧化产物是NaClO,请写出“尾气吸收装置”中反应的离子方程式:_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com