




 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
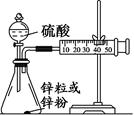
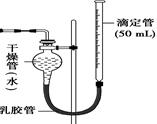
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定没有N2,CO和HCl中至少有一种 |
| B.一定有N2、HCl和CO |
| C.一定有N2,CO和HCl中至少有一种 |
| D.一定有N2和HCl,没有CO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 编号 | 实验内容 | 实验目的 |
| A | 将SO2通入酸性KMnO4溶液中 | 证明SO2具有氧化性 |
| B | 将Cl2通入NaBr溶液中 | 比较氯离子与溴离子的氧化性强弱 |
| C | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学平衡的影响 |
| D | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 | 研究催化剂对H2O2分解速率的影响 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
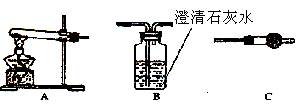
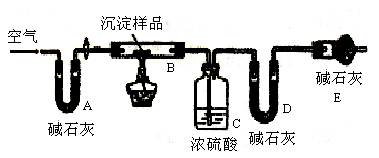
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
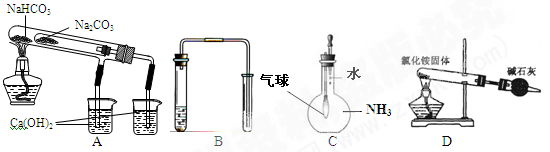
| A.验证NaHCO3和Na2CO3热稳定性大小 | B.用铜和稀硝酸制取并收集少量NO |
| C.验证明氨气的溶解性大小 | D.实验室用氯化铵制少量氨气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
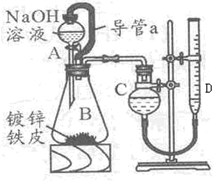
|

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
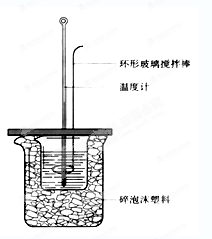
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com