
����Ŀ����ij��ȤС���ͬѧ����ͼ��ʾװ���о��йص绯ѧ������![]() �ס��ҡ�����������������
�ס��ҡ�����������������![]() ,���պϸ�װ�õĿ���Kʱ,�۲쵽�����Ƶ�ָ�뷢����ƫת����ش��������⣺
,���պϸ�װ�õĿ���Kʱ,�۲쵽�����Ƶ�ָ�뷢����ƫת����ش��������⣺
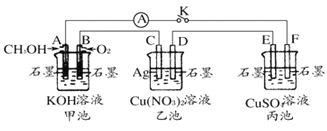
(1)�ס��ҡ���������Ϊԭ��ص���______ (�����׳��������ҳ�������������)��
(2)д���׳���A�缫�ĵ缫��Ӧʽ____________��
(3)������F�缫Ϊ______ (����������������������������������������),�óص��ܷ�Ӧ��ѧ����ʽΪ_________��
(4)���ҳ���C�缫��������![]() ʱ,�׳���B�缫����������
ʱ,�׳���B�缫����������![]() �����Ϊ____mL(���)��
�����Ϊ____mL(���)��
(5)һ��ʱ���,�Ͽ�����K������������ʹ���ػָ�����ӦǰŨ�ȵ���____ (��ѡ����ĸ)��
A.Cu ![]()
![]()
![]()
������ʺϵ�����,����Ӧ![]() ,��Ƴ�����ͼ��ʾװ�á���ش��������⣺
,��Ƴ�����ͼ��ʾװ�á���ش��������⣺
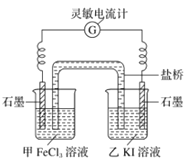
(6)��Ӧ��ʼʱ,����ʯī�缫�Ϸ���___(����������������ԭ��)��Ӧ,�缫��ӦʽΪ_______�������е�__ (����������������)���������Һ�����ƶ���
(7)�����ƶ���Ϊ0ʱ,��Ӧ�ﵽƽ��״̬,��ʱ�ڼ��м���![]() ����,����е�ʯī��______
����,����е�ʯī��______![]() ����������������
����������������![]() ��,�õ缫�ĵ缫��ӦʽΪ_______________��
��,�õ缫�ĵ缫��ӦʽΪ_______________��
(��)���������һ�����Ϳɳ����,����ͨ���ܵ�����,�õ�س�ʱ�䱣���ȶ��ķŵ��ѹ��������ص��ܷ�ӦΪ��![]()
![]()
![]() ��
��
(8)�ŵ�ʱ������ӦΪ______, ���ʱ������ӦΪ_______,�ŵ�ʱ����������Һ�ļ���___![]() ѡ������ǿ��������������������
ѡ������ǿ��������������������![]() ��
��
���𰸡��׳� CH3OH-6e-+8OH-=CO32-+6H2O ���� 2CuSO4+2H2O![]() 2H2SO4+2Cu+O2�� 560 BC ���� 2I--2e-=I2 �� �� Fe2+-e-=Fe3+ Zn-2e-+2OH-�TZn(OH)2 Fe(OH)3-3e-+5OH-=FeO42-+4H2O ��ǿ
2H2SO4+2Cu+O2�� 560 BC ���� 2I--2e-=I2 �� �� Fe2+-e-=Fe3+ Zn-2e-+2OH-�TZn(OH)2 Fe(OH)3-3e-+5OH-=FeO42-+4H2O ��ǿ
��������
��. ��ͼ��֪��ͼΪԭ�����һ�״�ȼ�ϵ�أ�ͨ�״���AΪ������BΪ�������������ҺΪKOH��Һ����A�缫��Ӧ����ʽΪ��2CH3OH+16OH--12e-�TCO32-+12H2O��B�缫��ӦʽΪ��3O2+12e-+6H2O=12OH-���ҳ�Ϊ���أ�CΪ�����缫��ӦΪ��Ag-e-=Ag+��D���������缫��ӦΪCu2++2e-=Cu������Ϊ���أ�EΪ�������缫��ӦΪ��4OH--4e-=O2��+2H2O��F�缫Ϊ�������缫��ӦΪ��Cu2++2e-=Cu�����ܷ�Ӧ����ʽΪ��2CuSO4+2H2O![]() 2H2SO4+2Cu+O2����һ��ʱ��Ͽ����K��Ҫʹ���ػָ�����ӦǰŨ�������CuO����CuCO3���ݴ˷������
2H2SO4+2Cu+O2����һ��ʱ��Ͽ����K��Ҫʹ���ػָ�����ӦǰŨ�������CuO����CuCO3���ݴ˷������
��. (6) ��Ӧ��ʼʱ�����е�����ʧ���ӷ���������Ӧ���缫��ӦʽΪ��2I--2e-=I2��Fe3+����ԭ��Fe2+��������ԭ��Ӧ���缫��ӦʽΪ��Fe3++e-=Fe2+�������е����������������ƶ���
(7) ��Ӧ�ﵽƽ�������м�������FeCl2���壬Fe2+Ũ������ƽ�������ƶ�����Fe2+ʧȥ��������Fe3+��
��. (8) �ŵ�ʱ��Zn����������Zn(OH)2��������Ϊ���أ�Fe(OH)3ʧȥ��������K2FeO4���ŵ�ʱ���������������������ӡ�
��.(1) ��ͼ��֪�׳�Ϊԭ��أ�
(2) ��ͼ��֪��ͼΪԭ�����һ�״�ȼ�ϵ�أ�ͨ�״���AΪ�������缫��ӦʽΪCH3OH-6e-+8OH-=CO32-+6H2O��
(3)������F�缫��ȼ�ϵ�صĸ�����������F�缫Ϊ���ص��������óص��ܷ�Ӧ��ѧ����ʽΪ2CuSO4+2H2O![]() 2H2SO4+2Cu+O2����
2H2SO4+2Cu+O2����
(4) �ҳ�Ϊ���أ�CΪ�����缫��ӦΪ��Ag-e-=Ag+��D���������缫��ӦΪCu2++2e-=Cu���ҳ���C����������10.8g���������ʵ���n(Ag)=![]() =0.1mol����ת�Ƶ���Ϊ0.1mol���ʼ׳�����O2Ϊ0.1 mol��
=0.1mol����ת�Ƶ���Ϊ0.1mol���ʼ׳�����O2Ϊ0.1 mol��![]() =0.025mol���������Ϊ0.025 mol��22.4L/mol=0.56L=560mL��
=0.025mol���������Ϊ0.025 mol��22.4L/mol=0.56L=560mL��
(5) һ��ʱ��Ͽ����K��Ҫʹ���ػָ�����ӦǰŨ�ȣ�����2CuSO4+2H2O![]() 2H2SO4+2Cu+O2����֪�������CuO����CuCO3��CuO��������������ͭ��ˮ��CuCO3��������������ͭ��������̼��ˮ���ʴ�ΪBC��
2H2SO4+2Cu+O2����֪�������CuO����CuCO3��CuO��������������ͭ��ˮ��CuCO3��������������ͭ��������̼��ˮ���ʴ�ΪBC��
��.(6) ��Ӧ��ʼʱ�����е�����ʧ���ӷ���������Ӧ��Ϊ���������缫��ӦʽΪ��2I--2e-=I2�������е����������������ƶ����������Һ�����ƶ���
(7) ��Ӧ�ﵽƽ�������м�������FeCl2���壬Fe2+Ũ������ƽ�������ƶ�����Fe2+ʧȥ��������Fe3+���׳��е�ʯī�������������ĵ缫��ӦʽΪFe2+-e-=Fe3+��
��. (8) �ŵ�ʱ��Zn����������Zn(OH)2���Ǹ���������ӦʽΪ��Zn-2e-+2OH-�TZn(OH)2��������Ϊ���أ����ʱ������Fe(OH)3ʧȥ��������K2FeO4���缫��ӦʽΪ��Fe(OH)/span>3-3e-+5OH-=FeO42-+4H2O���ŵ�ʱ���������������������ӣ���Һ�ļ�����ǿ��


 ������ÿ�ʱ�Ż���ҵϵ�д�
������ÿ�ʱ�Ż���ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ����һ����Ҫ�ķǽ���Ԫ�أ����γɶ��ֻ�����Իش������й����⣺
��1������֪4CO(g)+2NO2(g)4CO2(g)+N2(g) ��H=-1200kJmol-1�����ڸ÷�Ӧ���ı�ijһ��Ӧ������(��֪�¶�T2>T1)����ͼ����ͼ1��ȷ����___(�����)��

����֪CO��H2O��һ�������¿��Է�����Ӧ��CO(g)+H2O(g)CO2(g)+H2(g) ��H=-QkJmol-1��820��ʱ���ڼס������������ܱ������У���ʼʱ�����±�����Ͷ�ϣ�����һ��ʱ���ﵽƽ��״̬��������CO��ת����Ϊ40%����÷�Ӧ��ƽ�ⳣ��Ϊ___�����������յ�����Ϊ___��
�� | �� |
0.10molH2O | 0.20molH2 |
0.10molCO | 0.20molCO2 |
��2����ˮ����������������֪25��ʱ��Ksp[Fe(OH)3]=2.6��10-39��Ksp[Al(OH)3]=1.1��10-33����Ũ�Ⱦ�Ϊ0.1molL-1��FeCl3��AlCl3�����Һ�м��백ˮ���������ɵij�����___(�ѧʽ)��
��3���¿���Ϊ�����������ȼ�ϣ���������N2O4��Ӧ����N2��ˮ��������֪��
��N2(g)+2O2(g)=N2O4(l) ��H=-19.5kJmol-1
��N2H4(l)+O2(g)=N2(g)+2H2O(g) ��H=-534.2kJmol-1
д������������������Ӧ���Ȼ�ѧ����ʽ___��
��4�����ĵ�����(HN3)����ɫҺ�壬����������������������25mL0.1molL-1NaOH��Һ�м���0.2molL-1HN3����Һ���μӹ����е�pHֵ�ı仯����(��Һ���ʱ������仯���Բ���)��ͼ2��

�ٸ���ͼ��д��HN3�ĵ��뷽��ʽ��___��
������˵����ȷ����___(�����)��
A.������֪Ũ�ȵ�NaOH��Һ�ζ�HN3��Һ���ⶨHN3��Ũ��ʱӦ�ü�����ָʾ��
B.�����£���0.2molL-1HN3����Һ�м�ˮϡ�ͣ���![]() ����
����
C.�ֱ��к�pH��Ϊ4��HN3��Һ��HCl��Һ������0.1molL-1NaOH��Һ�������ͬ
D.D��ʱ��Һ������Ũ�ȴ������¹�ϵ��2c(H+)+c(HN3)=c(N3-)+2c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڷ�Ӧ�ȵ���������ȷ���ǣ� ��
A.HCl��NaOH��Ӧ���к�����H��-57.3kJ/mol����H2SO4��Ba(OH)2��Ӧ����1molH2Oʱ��ų�57.3kJ������
B.�����ȼ����Ϊ890.3kJ��mol-1�����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪCH4(g)+2O2(g)=CO2(g)+2H2O(l) ��H��-890.3kJ��mol-1
C.һ�������£���0.5molN2��l.5molH2�����ܱ������г�ַ�Ӧ����NH3������19.3kJ�������Ȼ�ѧ����ʽΪ��N2(g)+3H2(g)![]() 2NH3(g) ��H��-38.6kJ��mol-1
2NH3(g) ��H��-38.6kJ��mol-1
D.��S(s)+O2(g)��SO2(g) ��H1��S(g)+O2(g)��SO2(g) ��H2����H1<��H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ʵ������Zn��ϡ������H2��Ϊ�ӿ췴Ӧ���ʣ�����ϡ�����м�������Cu��
B. CH3Cl(g)��Cl2(g)![]() CH2Cl2(l)��HCl(g)���������Է����У���÷�Ӧ�Ħ�H>0
CH2Cl2(l)��HCl(g)���������Է����У���÷�Ӧ�Ħ�H>0
C. ��һ����ɱ�ĺ����ܱ������з�����ӦPCl3(g)��Cl2(g) ![]() PCl5(g)��ѹ�������ƽ�������ƶ���Kֵ����
PCl5(g)��ѹ�������ƽ�������ƶ���Kֵ����
D. 25��ʱKa(HClO)��3.0��10��8��Ka(HCN)��4.9��10��10�������¶���NaClO��Һ��NaCN��ҺpH��ͬ����c(NaClO)<c(NaCN)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ��ȼ�ϵ�����������ȼ�ϵ�ؾ������С���ŵ㣮һ����Һ̬�£�N2H4��Ϊȼ�ϵĵ��װ����ͼ��ʾ���õ���ÿ����е�������Ϊ��������KOH��Һ��Ϊ�������Һ�����ڸõ�ص�������ȷ���ǣ�������

A. b������������Ӧ
B. a��Ϊ�õ�ص�����
C. �ŵ�ʱ��������a��������������b��
D. a���ķ�Ӧʽ��N2H4+4OH����4e���TN2��+4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ʵ�Ľ�����ȷ����![]()
ѡ�� | �������ʵ | ���� |
A | ���ȵĴ�����Һϴȥ���� |
|
B | Ư���ڿ����о��ñ��� | Ư���е� |
C | ʩ��ʱ����ľ�� |
|
D | �����ڳ�ʪ�Ŀ������������� | �����ڿ����з��������ⸯʴ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������ΪV L���ܱ������з�����ѧ��ӦCO(g)��2H2(g) ![]() CH3OH(g)�����жϸÿ��淴Ӧ�ﵽ��ѧƽ��״̬�ı�־��(����)
CH3OH(g)�����жϸÿ��淴Ӧ�ﵽ��ѧƽ��״̬�ı�־��(����)
A.v����(CH3OH)��v����(CO)B.���������ܶȲ��ٸı�
C.��������ƽ����Է����������ٸı�D.CO��H2��CH3OH��Ũ�ȱ�Ϊ1:2:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ȥ�����е�Ca2+��Mg2+��Fe3+��SO42+�Լ���ɳ�����ʣ�ijͬѧ�����һ���Ʊ����ε�ʵ�鷽�����������£����ڳ������Լ��Թ�������
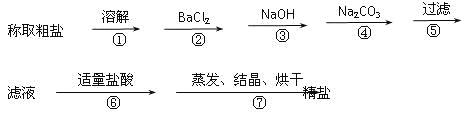
(1)�ж�BaCl2�ѹ����ķ�����_________________________��
(2)�������У���ص����ӷ���ʽ��___________��__________��
(3)�����������pHֵ�ٹ��ˣ�����ʵ��������Ӱ�죬��ԭ����_____________��
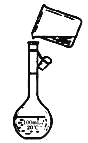
(4)Ϊ���龫�δ��ȣ�������150 mL.0.2 mol/L NaCl(����)��Һ����ͼ�Ǹ�ͬѧת����Һ��ʾ��ͼ��ͼ�еĴ�����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���
A.������ˮ��Һ�м����������S2-������
B.������������ڰ���������Ӧ
C.��ѹ�����ںϳɰ���Ӧ
D.��������ˮ�м���̼��������ڴ�����Ũ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com