
ΓΨΧβΡΩΓΩœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A. Β―ι “”ΟZnΚΆœΓΝρΥα÷ΤH2Θ§ΈΣΦ”ΩλΖ¥”ΠΥΌ¬ Θ§Ω…œρœΓΝρΥα÷–Φ”»κ…ΌΝΩCuΖέ
B. CH3Cl(g)ΘΪCl2(g)![]() CH2Cl2(l)ΘΪHCl(g)≥ΘΈ¬œ¬ΡήΉ‘ΖΔΫχ––Θ§‘ρΗΟΖ¥”ΠΒΡΠΛH>0
CH2Cl2(l)ΘΪHCl(g)≥ΘΈ¬œ¬ΡήΉ‘ΖΔΫχ––Θ§‘ρΗΟΖ¥”ΠΒΡΠΛH>0
C. ‘Ύ“ΜΧεΜΐΩ…±δΒΡΚψΈ¬Οή±’»ίΤς÷–ΖΔ…ζΖ¥”ΠPCl3(g)ΘΪCl2(g) ![]() PCl5(g)Θ§―ΙΥθΧεΜΐΘ§ΤΫΚβ’ΐœρ“ΤΕ·Θ§K÷Β‘ω¥σ
PCl5(g)Θ§―ΙΥθΧεΜΐΘ§ΤΫΚβ’ΐœρ“ΤΕ·Θ§K÷Β‘ω¥σ
D. 25Γφ ±Ka(HClO)ΘΫ3.0ΓΝ10Θ≠8Θ§Ka(HCN)ΘΫ4.9ΓΝ10Θ≠10Θ§»τΗΟΈ¬Ε»œ¬NaClO»ή“Κ”κNaCN»ή“ΚpHœύΆ§Θ§‘ρc(NaClO)<c(NaCN)
ΓΨ¥πΑΗΓΩA
ΓΨΫβΈωΓΩAΓΔœΓΝρΥα÷–Φ”»κ…ΌΝΩCuΖέΘ§Zn-H2SO4-CuΙΙ≥…‘≠Βγ≥ΊΘ§Ω…“‘Φ”ΩλΖ¥”ΠΥΌ¬ Θ§A’ΐ»ΖΘΜBΓΔCH3Cl(g)ΘΪCl2(g)![]() CH2Cl2(l)ΘΪHCl(g)ΒΡλΊ±δ–Γ”Ύ0Θ§≥ΘΈ¬œ¬ΡήΉ‘ΖΔΫχ––Θ§ΗυΨίΗ¥Κœ≈–ΨίΩ…÷ΣΗΟΖ¥”ΠΒΡΠΛH“ΜΕ®–Γ”Ύ0Θ§B¥μΈσΘΜCΓΔΚψΈ¬œ¬―ΙΥθΧεΜΐœύΒ±”Ύ‘ω¥σ―Ι«ΩΘ§ΗΟΖ¥”ΠΒΡΤΫΚβ’ΐœρ“ΤΕ·Θ§Έ¬Ε»≤Μ±δΘ§K÷Β≤Μ±δΘ§C¥μΈσΘΜDΓΔKa(HClO)>Ka(HCN)Θ§HClOΒΡΥα–‘¥σ”ΎHCNΒΡΥα–‘Θ§Υυ“‘œύΆ§≈®Ε»ΒΡClO-ΒΡΥ°Ϋβ≥ΧΕ»–Γ”ΎCN-ΒΡΥ°Ϋβ≥ΧΕ»Θ§«Α’ΏΥ°ΫβΒΟΒΫΒΡOH-≈®Ε»–Γ”ΎΚσ’ΏΥ°ΫβΒΟΒΫΒΡOH-≈®Ε»Θ§“Σ ΙΝΫ’ΏΥ°ΫβΒΟΒΫΒΡOH-≈®Ε»œύΆ§Θ§‘ρNaClOΒΡ≈®Ε»“Σ¥σ”ΎNaCNΒΡ≈®Ε»Θ§D¥μΈσΓΘ’ΐ»Ζ¥πΑΗΈΣAΓΘ
CH2Cl2(l)ΘΪHCl(g)ΒΡλΊ±δ–Γ”Ύ0Θ§≥ΘΈ¬œ¬ΡήΉ‘ΖΔΫχ––Θ§ΗυΨίΗ¥Κœ≈–ΨίΩ…÷ΣΗΟΖ¥”ΠΒΡΠΛH“ΜΕ®–Γ”Ύ0Θ§B¥μΈσΘΜCΓΔΚψΈ¬œ¬―ΙΥθΧεΜΐœύΒ±”Ύ‘ω¥σ―Ι«ΩΘ§ΗΟΖ¥”ΠΒΡΤΫΚβ’ΐœρ“ΤΕ·Θ§Έ¬Ε»≤Μ±δΘ§K÷Β≤Μ±δΘ§C¥μΈσΘΜDΓΔKa(HClO)>Ka(HCN)Θ§HClOΒΡΥα–‘¥σ”ΎHCNΒΡΥα–‘Θ§Υυ“‘œύΆ§≈®Ε»ΒΡClO-ΒΡΥ°Ϋβ≥ΧΕ»–Γ”ΎCN-ΒΡΥ°Ϋβ≥ΧΕ»Θ§«Α’ΏΥ°ΫβΒΟΒΫΒΡOH-≈®Ε»–Γ”ΎΚσ’ΏΥ°ΫβΒΟΒΫΒΡOH-≈®Ε»Θ§“Σ ΙΝΫ’ΏΥ°ΫβΒΟΒΫΒΡOH-≈®Ε»œύΆ§Θ§‘ρNaClOΒΡ≈®Ε»“Σ¥σ”ΎNaCNΒΡ≈®Ε»Θ§D¥μΈσΓΘ’ΐ»Ζ¥πΑΗΈΣAΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈΣ≤βΕ®Ρ≥―Σ“Κ―υΤΖ÷–ΗΤάκΉ”ΒΡΚ§ΝΩΘ§Ω…»ΓΗΟ―υΤΖ2.00mL”Ο’τΝσΥ°œΓ ΆΚσΘ§œρΤδ÷–Φ”»κΉψΝΩ≤ίΥαοß(NH4)2C2O4ΨßΧεΘ§Ζ¥”Π…ζ≥…CaC2O4≥ΝΒμΓΘΫΪ≥ΝΒμ”ΟœΓΝρΥα¥ΠάμΒΟH2C2O4ΚσΘ§‘Ό”Ο1.000ΓΝ10-4molL-1Υα–‘KMnO4±ξΉΦ»ή“ΚΒΈΕ®Θ§ΒΫ¥ο÷’Βψ ±”Ο»Ξ20.00mL±ξΉΦ“ΚΓΘ‘ρœ¬Ν–ΥΒΖ®÷–¥μΈσΒΡ «Θ® Θ©
A.”ΟΥα–‘KMnO4(aq)ΒΈΕ®H2C2O4(aq)ΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚ2MnO4-+5H2C2O4+6H+=2Mn2++10CO2Γϋ+8H2O
B.KMnO4±ξΉΦ»ή“Κ”Π”ΟΦν ΫΒΈΕ®Ιή ΔΉΑ
C.ΒΈΕ®÷’Βψ ±ΒΡœ÷œσΈΣΘΚΉνΚσ1ΒΈ±ξΉΦKMnO4(aq) ΙΉΕ–ΈΤΩ÷–»ή“Κ”…Έό…Ϊ±δΈΣ«≥Ήœ…ΪΘ§«“‘ΦΑκΖ÷÷”ΡΎ≤ΜΆ …Ϊ
D.Ψ≠ΦΤΥψΗΟ―υΤΖ÷–ΗΤάκΉ”≈®Ε»ΈΣ1.000ΓΝ10-4gmL-1
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≥ΘΈ¬œ¬Θ§œρ10 mL 0.1 molΓΛLΘ≠1ΒΡHR»ή“Κ÷–÷πΒΈΒΈ»κ0.1 molΓΛLΘ≠1ΒΡNH3ΓΛH2O»ή“ΚΘ§ΥυΒΟ»ή“ΚpHΦΑΒΦΒγ–‘±δΜ·»γΆΦΓΘœ¬Ν–Ζ÷Έω’ΐ»ΖΒΡ «

A. bΓΪc»ή“Κ÷–Υυ”–άκΉ”≈®Ε»ΕΦΦθ–Γ
B. bΒψ»ή“ΚpHΘΫ7Θ§ΥΒΟςNH4RΟΜ”–Υ°Ϋβ
C. cΒψ»ή“Κ÷–¥φ‘Ύc(RΘ≠) > c(NH4+)ΓΔc(HΘΪ)> c(OHΘ≠)
D. aΓΪbΒΦΒγΡήΝΠ‘ω«ΩΘ§ΥΒΟςHRΈΣ»θΥα
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΔώΘ°Θ®1Θ©ΙΛ“ΒΖœΥ°÷–≥ΘΚ§”–Cu2+Β»÷ΊΫπ τάκΉ”Θ§÷±Ϋ”≈≈Ζ≈Μα‘λ≥…Έέ»ΨΘ§ΡΩ«Α‘ΎΙΛ“ΒΖœΥ°¥ΠάμΙΐ≥Χ÷–Θ§“άΨί≥ΝΒμΉΣΜ·ΒΡ‘≠άμΘ§≥Θ”ΟFeSΒ»Ρ―»ήΈο÷ ΉςΈΣ≥ΝΒμΦΝ≥ΐ»Ξ’β–©άκΉ”ΓΘ“―÷Σ “Έ¬œ¬Ksp(FeS)=6.3ΓΝ10-18Θ§Ksp(CuS)=1.3ΓΝ10-36ΓΘ«κ”ΟάκΉ”ΖΫ≥Χ ΫΥΒΟς…œ ω≥ΐ‘”ΒΡ‘≠άμ__ΓΘ
Θ®2Θ©‘ΎtΓφ ±Θ§Ρ≥NaOHœΓ»ή“Κ÷–Θ§c(HΘΪ)ΘΫ10-amol/LΘ§c(OHΘ≠)ΘΫ10-bmol/LΘ§“―÷ΣaΘΪbΘΫ12Θ§‘ρΗΟΈ¬Ε»œ¬Υ°ΒΡάκΉ”Μΐ≥Θ ΐKWΘΫ__ΓΘ‘ΎΗΟΈ¬Ε»œ¬Θ§ΫΪ100mL0.1mol/LΒΡœΓΝρΥα”κ100mL0.4mol/LΒΡNaOH»ή“ΚΜλΚœΚσΘ§»ή“ΚΒΡpHΘΫ___ΓΘ
ΔρΘ°ΙΛ“Β…ζ≥…ΡρΥΊΒΡ‘≠άμ «“‘NH3ΚΆCO2ΈΣ‘≠ΝœΚœ≥…ΡρΥΊΘ§Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ2NH3(g)+ CO2(g)![]() CO(NH2)2(1)+H2O(1)Θ§ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐΚΆΈ¬Ε»ΙΊœΒ»γœ¬ΘΚ
CO(NH2)2(1)+H2O(1)Θ§ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐΚΆΈ¬Ε»ΙΊœΒ»γœ¬ΘΚ
T/Γφ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
Θ®1Θ©ΠΛH___0Θ®ΧνΓΑΘΨΓ±ΓΔΓΑΘΦΓ±ΜρΓΑ=Γ±Θ©ΓΘ
Θ®2Θ©‘Ύ“ΜΕ®Έ¬Ε»ΚΆ―Ι«Ωœ¬Θ§»τ‘≠ΝœΤχ÷–ΒΡNH3ΚΆCO2ΒΡΈο÷ ΒΡΝΩ÷°±»Θ®Α±ΧΦ±»Θ©n(NH3)ΓΟn(CO2)ΘΫxΘ§»γΆΦ «Α±ΧΦ±»Θ®xΘ©”κCO2ΤΫΚβΉΣΜ·¬ Θ®ΠΝΘ©ΒΡΙΊœΒΘ§ΠΝΥφΉ≈x‘ω¥σΕχ‘ω¥σΒΡ‘≠“ρ «___ΓΘ
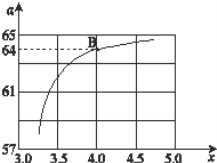
Θ®3Θ©ΆΦ÷–ΒΡBΒψΕ‘”ΠΒΡNH3ΒΡΤΫΚβΉΣΜ·¬ ΈΣ__ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≥ΘΈ¬œ¬Θ§œρ![]() »ή“Κ÷–÷πΒΈΦ”»κ
»ή“Κ÷–÷πΒΈΦ”»κ![]() ±Θ§»ή“ΚΒΡpH”κΥυΦ”NaOH»ή“ΚΧεΜΐΒΡΙΊœΒ»γΆΦΥυ ΨΘ®≤ΜΩΦ¬«Μ”ΖΔΘ©ΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©
±Θ§»ή“ΚΒΡpH”κΥυΦ”NaOH»ή“ΚΧεΜΐΒΡΙΊœΒ»γΆΦΥυ ΨΘ®≤ΜΩΦ¬«Μ”ΖΔΘ©ΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©
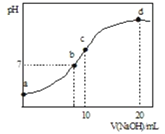
A.ΒψaΥυ Ψ»ή“Κ÷–ΘΚ![]()
B.ΒψbΥυ Ψ»ή“Κ÷–ΘΚ![]()
C.ΒψcΥυ Ψ»ή“Κ÷–ΘΚ![]()
D.ΒψdΥυ Ψ»ή“Κ÷–ΘΚ![]()
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΙΊ”Ύ![]() »ή“ΚΒΡ–π ω’ΐ»ΖΒΡ «
»ή“ΚΒΡ–π ω’ΐ»ΖΒΡ «![]()
A.![]() ΥΉΟϊ¥ΩΦνΘ§ΤδΥ°»ή“Κœ‘»θΦν–‘
ΥΉΟϊ¥ΩΦνΘ§ΤδΥ°»ή“Κœ‘»θΦν–‘
B.ΗΟ»ή“Κ÷–![]() ΓΔ
ΓΔ![]() ΓΔ
ΓΔ![]() Ω…“‘¥σΝΩΙ≤¥φ
Ω…“‘¥σΝΩΙ≤¥φ
C.Φ”Υ°œΓ ΆΗΟ»ή“ΚΘ§»ή“Κ÷–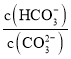 ‘ω¥σ
‘ω¥σ
D.œρΗΟ»ή“Κ÷–Φ”»κΉψΝΩΒΡ«β―θΜ·ΗΤ»ή“ΚΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚ![]()
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΔώΡ≥–Υ»Λ–ΓΉιΒΡΆ§―ß”Οœ¬ΆΦΥυ ΨΉΑ÷Ο―–ΨΩ”–ΙΊΒγΜ·―ßΒΡΈ Χβ![]() ΦΉΓΔ““ΓΔ±ϊ»ΐ≥Ί÷–»ή÷ ΉψΝΩ
ΦΉΓΔ““ΓΔ±ϊ»ΐ≥Ί÷–»ή÷ ΉψΝΩ![]() ,Β±±’ΚœΗΟΉΑ÷ΟΒΡΩΣΙΊK ±,Ιέ≤λΒΫΒγΝςΦΤΒΡ÷Η’κΖΔ…ζΝΥΤΪΉΣΓΘ«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
,Β±±’ΚœΗΟΉΑ÷ΟΒΡΩΣΙΊK ±,Ιέ≤λΒΫΒγΝςΦΤΒΡ÷Η’κΖΔ…ζΝΥΤΪΉΣΓΘ«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
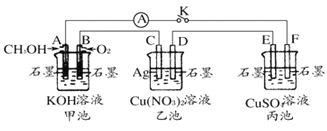
(1)ΦΉΓΔ““ΓΔ±ϊ»ΐ≥Ί÷–ΈΣ‘≠Βγ≥ΊΒΡ «______ (ΧνΓΑΦΉ≥ΊΓ±ΓΔΓΑ““≥ΊΓ±ΜρΓΑ±ϊ≥ΊΓ±)ΓΘ
(2)–¥≥ωΦΉ≥Ί÷–AΒγΦΪΒΡΒγΦΪΖ¥”Π Ϋ____________ΓΘ
(3)±ϊ≥Ί÷–FΒγΦΪΈΣ______ (ΧνΓΑ’ΐΦΪΓ±ΓΔΓΑΗΚΦΪΓ±ΓΔΓΑ“θΦΪΓ±ΜρΓΑ―τΦΪΓ±),ΗΟ≥ΊΒΡΉήΖ¥”ΠΜ·―ßΖΫ≥Χ ΫΈΣ_________ΓΘ
(4)Β±““≥Ί÷–CΒγΦΪ÷ ΝΩΦθ«α![]() ±,ΦΉ≥Ί÷–BΒγΦΪάμ¬έ…œœϊΚΡ
±,ΦΉ≥Ί÷–BΒγΦΪάμ¬έ…œœϊΚΡ![]() ΒΡΧεΜΐΈΣ____mL(±ξΩω)ΓΘ
ΒΡΧεΜΐΈΣ____mL(±ξΩω)ΓΘ
(5)“ΜΕΈ ±ΦδΚσ,ΕœΩΣΩΣΙΊKΓΘœ¬Ν–Έο÷ Ρή Ι±ϊ≥ΊΜ÷Η¥ΒΫΖ¥”Π«Α≈®Ε»ΒΡ «____ (Χν―ΓœνΉ÷ΡΗ)ΓΘ
A.Cu ![]()
![]()
![]()
ΔρΩΊ÷Τ ΚœΒΡΧθΦΰ,ΫΪΖ¥”Π![]() ,…ηΦΤ≥…»γ…œΆΦΥυ ΨΉΑ÷ΟΓΘ«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
,…ηΦΤ≥…»γ…œΆΦΥυ ΨΉΑ÷ΟΓΘ«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(6)Ζ¥”ΠΩΣ Φ ±,““÷– ·ΡΪΒγΦΪ…œΖΔ…ζ___(ΧνΓΑ―θΜ·Γ±ΜρΓΑΜΙ‘≠Γ±)Ζ¥”Π,ΒγΦΪΖ¥”Π ΫΈΣ_______ΓΘ―Έ«≈÷–ΒΡ__ (ΧνΓΑ―τΓ±ΜρΓΑ“θΓ±)άκΉ”œρΦΉ»ή“ΚΖΫœρ“ΤΕ·ΓΘ
(7)ΒγΝςΦΤΕΝ ΐΈΣ0 ±,Ζ¥”Π¥οΒΫΤΫΚβΉ¥Χ§,¥Υ ±‘ΎΦΉ÷–Φ”»κ![]() ΙΧΧε,‘ρΦΉ÷–ΒΡ ·ΡΪΉς______
ΙΧΧε,‘ρΦΉ÷–ΒΡ ·ΡΪΉς______![]() ΧνΓΑ’ΐΓ±ΜρΓΑΗΚΓ±
ΧνΓΑ’ΐΓ±ΜρΓΑΗΚΓ±![]() ΦΪ,ΗΟΒγΦΪΒΡΒγΦΪΖ¥”Π ΫΈΣ_______________ΓΘ
ΦΪ,ΗΟΒγΦΪΒΡΒγΦΪΖ¥”Π ΫΈΣ_______________ΓΘ
(Δσ)ΗΏΧζΒγ≥Ί «“Μ÷÷–¬–ΆΩ…≥δΒγΒγ≥Ί,”κΤ’Ά®ΗΏΡήΒγ≥Ίœύ±»,ΗΟΒγ≥Ί≥Λ ±Φδ±Θ≥÷Έ»Ε®ΒΡΖ≈ΒγΒγ―ΙΓΘΗΏΧζΒγ≥ΊΒΡΉήΖ¥”ΠΈΣΘΚ![]()
![]()
![]() ΓΘ
ΓΘ
(8)Ζ≈Βγ ±ΗΚΦΪΖ¥”ΠΈΣ______, ≥δΒγ ±―τΦΪΖ¥”ΠΈΣ_______,Ζ≈Βγ ±’ΐΦΪΗΫΫϋ»ή“ΚΒΡΦν–‘___![]() ―ΓΧνΓΑ‘ω«ΩΓ±ΓΑΦθ»θΓ±ΜρΓΑ≤Μ±δΓ±
―ΓΧνΓΑ‘ω«ΩΓ±ΓΑΦθ»θΓ±ΜρΓΑ≤Μ±δΓ±![]() ΓΘ
ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≤…”ΟCO”κH2Ζ¥”ΠΚœ≥…‘Ό…ζΡή‘¥ΦΉ¥ΦΘ§Ζ¥”Π»γœ¬:COΘ®gΘ©+ 2H2Θ®gΘ©![]() CH3OHΘ®gΘ©Θ§‘Ύ“Μ»ίΜΐΩ…±δΒΡΟή±’»ίΤς÷–≥δ”–10molCOΚΆ20mol H2Θ§‘Ύ¥ΏΜ·ΦΝΉς”Οœ¬ΖΔ…ζΖ¥”Π…ζ≥…ΦΉ¥ΦΓΘCOΒΡΤΫΚβΉΣΜ·¬ Θ®ΠΝΘ©”κΈ¬Ε»Θ®TΘ©ΓΔ―Ι«ΩΘ®pΘ©ΒΡΙΊœΒ»γΆΦΥυ ΨΓΘ‘ρœ¬Ν–άμΫβ≤ΜΖϊΚœΧβ“βΒΡ «
CH3OHΘ®gΘ©Θ§‘Ύ“Μ»ίΜΐΩ…±δΒΡΟή±’»ίΤς÷–≥δ”–10molCOΚΆ20mol H2Θ§‘Ύ¥ΏΜ·ΦΝΉς”Οœ¬ΖΔ…ζΖ¥”Π…ζ≥…ΦΉ¥ΦΓΘCOΒΡΤΫΚβΉΣΜ·¬ Θ®ΠΝΘ©”κΈ¬Ε»Θ®TΘ©ΓΔ―Ι«ΩΘ®pΘ©ΒΡΙΊœΒ»γΆΦΥυ ΨΓΘ‘ρœ¬Ν–άμΫβ≤ΜΖϊΚœΧβ“βΒΡ «
A. BΒψΒΡΥΌ¬ ±»CΒψΒΡ¥σ
B. AΓΔBΓΔC»ΐΒψΒΡΤΫΚβ≥Θ ΐKAΓΔKBΓΔKCΒΡ¥σ–ΓΙΊœΒΈΣΘΚKA=KB>KC
C. »τ¥οΒΫΤΫΚβΉ¥Χ§A ±Θ§»ίΤςΒΡΧεΜΐΈΣ10LΘ§‘ρ‘ΎΤΫΚβΉ¥Χ§B ±»ίΤςΒΡΧεΜΐΈΣ2L
D. Κœ≥…ΦΉ¥ΦΒΡΖ¥”ΠΈΣΖ≈»»Ζ¥”Π
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘Ύ»ίΜΐΈΣ1 LΒΡΚψ»ίΟή±’»ίΤς÷–≥δ»κCO(g)ΚΆH2O(g)Θ§ΖΔ…ζΖ¥”ΠΘΚCO(g) + H2O(g)![]() CO2(g) + H2(g) ΠΛH<0Θ§ΥυΒΟ Β―ι ΐΨί»γœ¬±μΘΚ
CO2(g) + H2(g) ΠΛH<0Θ§ΥυΒΟ Β―ι ΐΨί»γœ¬±μΘΚ
Β―ι ±ύΚ≈ | Έ¬Ε»/Γφ | Τπ Φ ±Έο÷ ΒΡΝΩ/mol | ΤΫΚβ ±Έο÷ ΒΡΝΩ/mol | |
n(CO) | n(H2O) | n(CO2) | ||
ΔΌ | 700 | 0.40 | 0.10 | 0.090 |
ΔΎ | 800 | 0.10 | 0.40 | 0.080 |
Δέ | 800 | 0.20 | 0.30 | a |
Δή | 900 | 0.10 | 0.15 | b |
œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A. Β―ιΔΌ÷–Θ§»τ5 min ±≤βΒΟn (CO2) =0.050 molΘ§‘ρ0÷Ν5 min ±ΦδΡΎΘ§”ΟH2±μ ΨΒΡΤΫΨυΖ¥”ΠΥΌ¬ Π‘ (H2) = 5.0ΓΝ10Θ≠2 mol/(LΓΛmin)
B. Β―ιΔΎ÷–Θ§ΗΟΧθΦΰœ¬Ζ¥”ΠΒΡΤΫΚβ≥Θ ΐK =2.0
C. Β―ιΔέ÷–Θ§¥οΒΫΤΫΚβ ±Θ§COΒΡΉΣΜ·¬ ΈΣ60%
D. Β―ιΔή÷–Θ§¥οΒΫΤΫΚβ ±Θ§bΘΨ0.060
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com