
【题目】Ⅰ.(1)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18,Ksp(CuS)=1.3×10-36。请用离子方程式说明上述除杂的原理__。
(2)在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则该温度下水的离子积常数KW=__。在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=___。
Ⅱ.工业生成尿素的原理是以NH3和CO2为原料合成尿素,反应的化学方程式为2NH3(g)+ CO2(g)![]() CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
(1)ΔH___0(填“>”、“<”或“=”)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)n(NH3)∶n(CO2)=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___。
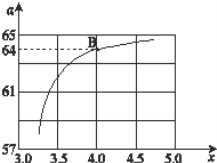
(3)图中的B点对应的NH3的平衡转化率为__。
【答案】FeS+Cu2+=Fe2++CuS 10-12 11 < x越大,则NH3的相对量越多,即相当于平衡体系中增大NH3浓度,平衡正向移动,CO2的转化率增大 32%
【解析】
Ⅰ.(1)由于室温下Ksp(FeS)=6.3×10-18,Ksp(CuS)=1.3×10-36,在相同条件下CuS的溶解度更小,沉淀会向着生成CuS的方向进行,因此上述除杂的原理是FeS与Cu2+反应,生成Fe2+和CuS,离子方程式为FeS+Cu2+=Fe2++CuS。答案为:FeS+Cu2+=Fe2++CuS;
(2)该温度下水的离子积常数KW=c(H+)c(OH-)=10-a×10-b=10-(a+b)=10-12。答案为:10-12;在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,反应后溶液的c(OH-)=![]() =0.1mol/L,c(H+)=10-11mol/L,pH=11。答案为:11。
=0.1mol/L,c(H+)=10-11mol/L,pH=11。答案为:11。
Ⅱ.(1)从表中数据可以看出,温度升高,平衡常数K减小,则平衡逆向移动,从而可确定ΔH<0。答案为:<;
(2)α随着x增大而增大的原因是x越大,则NH3量越多,即相当于平衡体系中加入NH3,增大NH3浓度,平衡正向移动,CO2的转化率增大。答案为:x越大,则NH3的相对量越多,即相当于平衡体系中增大NH3浓度,平衡正向移动,CO2的转化率增大;
(3)设n(NH3)=4mol,则n(CO2)=1mol。
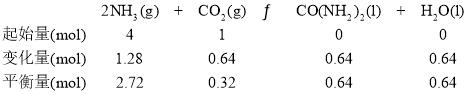
图中的B点对应的NH3的平衡转化率为![]() =32%。答案为:32%。
=32%。答案为:32%。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.稀释Na2CO3溶液时,c(HCO3-)、![]() 均增大
均增大
B.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的△H<0,△S<0
C.用0.1molL-1CH3COOH溶液滴定0.1molL-1NaOH至中性时:c(CH3COO-)+c(CH3COOH)=c(Na+)
D.向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,水的离子积减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图,下列说法不正确的是
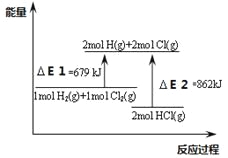
A.△E2是2mol HCl(g)的总键能
B.该反应的热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H =-183KJ.mol-1
C.通常情况下H2与Cl2混和不会反应
D.该反应是一个吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,在浓度为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测其c(NH4+)分别为a、b、c(单位为mol/L),下列判断正确的是
A. a=b=c B. a>b>c C. a>c>b D. c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应热的描述中正确的是( )
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应生成1molH2O时会放出57.3kJ的热量
B.甲烷的燃烧热为890.3kJ·mol-1,则表示甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
C.一定条件下,将0.5molN2和l.5molH2置于密闭容器中充分反应生成NH3,放热19.3kJ,则其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
D.若S(s)+O2(g)=SO2(g) △H1,S(g)+O2(g)=SO2(g) △H2;△H1<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学实验![]() 观察现象
观察现象![]() 分析推理一得出结论”是化学学习的方法之一,下列说法正确的是
分析推理一得出结论”是化学学习的方法之一,下列说法正确的是![]()
A.检验氯化铁溶液中是否有氯化亚铁,可取待测液加入酸性高锰酸钾溶液中,若酸性高锰酸钾溶液褪色,则证明一定有氯化亚铁
B.将![]() 通入足量稀
通入足量稀![]() 溶液中,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,假设通入的
溶液中,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,假设通入的![]() 完全反应,则同温同压下,逸出的气体和通入的
完全反应,则同温同压下,逸出的气体和通入的![]() 的体积比为2:3
的体积比为2:3
C.验证淀粉的水解产物是否具有还原性,取水解液于试管中并加入新制氢氧化铜悬浊液,加热煮沸,观察是否出现砖红色沉淀
D.向铝质容器中加入食盐溶液,再将变黑的银器浸人该溶液中,一段时后发现黑色褪去,该过程中发生的反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 实验室用Zn和稀硫酸制H2,为加快反应速率,可向稀硫酸中加入少量Cu粉
B. CH3Cl(g)+Cl2(g)![]() CH2Cl2(l)+HCl(g)常温下能自发进行,则该反应的ΔH>0
CH2Cl2(l)+HCl(g)常温下能自发进行,则该反应的ΔH>0
C. 在一体积可变的恒温密闭容器中发生反应PCl3(g)+Cl2(g) ![]() PCl5(g),压缩体积,平衡正向移动,K值增大
PCl5(g),压缩体积,平衡正向移动,K值增大
D. 25℃时Ka(HClO)=3.0×10-8,Ka(HCN)=4.9×10-10,若该温度下NaClO溶液与NaCN溶液pH相同,则c(NaClO)<c(NaCN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列现象或事实的解释正确的是![]()
选项 | 现象或事实 | 解释 |
A | 用热的纯碱溶液洗去油污 |
|
B | 漂白粉在空气中久置变质 | 漂白粉中的 |
C | 施肥时,草木灰 |
|
D | 钢铁在潮湿的空气中容易生锈 | 钢铁在空气中发生了析氢腐蚀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲除去下列物质中的杂质(括号内为杂质)所用试剂和操作方法都正确的( )
①Cl2(HCl):饱和食盐水、过滤
②CO2(SO2):饱和Na2CO3溶液、洗气
③铁粉(铝粉):NaOH溶液、过滤
④MnO2(KCl):水、溶解后过滤
⑤碳粉(碘单质):CCl4、分液
⑥C2H5OH(H2O):加新制CaO后蒸馏
A.①②③B.③④⑥C.②④⑤D.①④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com