
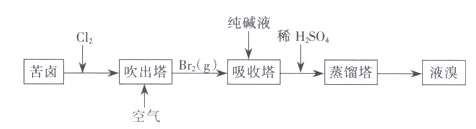
【题目】下列关于![]() 溶液的叙述正确的是
溶液的叙述正确的是![]()
A.![]() 俗名纯碱,其水溶液显弱碱性
俗名纯碱,其水溶液显弱碱性
B.该溶液中![]() 、
、![]() 、
、![]() 可以大量共存
可以大量共存
C.加水稀释该溶液,溶液中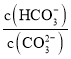 增大
增大
D.向该溶液中加入足量的氢氧化钙溶液的离子方程式为:![]()
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )

A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,在浓度为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测其c(NH4+)分别为a、b、c(单位为mol/L),下列判断正确的是
A. a=b=c B. a>b>c C. a>c>b D. c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学实验![]() 观察现象
观察现象![]() 分析推理一得出结论”是化学学习的方法之一,下列说法正确的是
分析推理一得出结论”是化学学习的方法之一,下列说法正确的是![]()
A.检验氯化铁溶液中是否有氯化亚铁,可取待测液加入酸性高锰酸钾溶液中,若酸性高锰酸钾溶液褪色,则证明一定有氯化亚铁
B.将![]() 通入足量稀
通入足量稀![]() 溶液中,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,假设通入的
溶液中,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,假设通入的![]() 完全反应,则同温同压下,逸出的气体和通入的
完全反应,则同温同压下,逸出的气体和通入的![]() 的体积比为2:3
的体积比为2:3
C.验证淀粉的水解产物是否具有还原性,取水解液于试管中并加入新制氢氧化铜悬浊液,加热煮沸,观察是否出现砖红色沉淀
D.向铝质容器中加入食盐溶液,再将变黑的银器浸人该溶液中,一段时后发现黑色褪去,该过程中发生的反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 实验室用Zn和稀硫酸制H2,为加快反应速率,可向稀硫酸中加入少量Cu粉
B. CH3Cl(g)+Cl2(g)![]() CH2Cl2(l)+HCl(g)常温下能自发进行,则该反应的ΔH>0
CH2Cl2(l)+HCl(g)常温下能自发进行,则该反应的ΔH>0
C. 在一体积可变的恒温密闭容器中发生反应PCl3(g)+Cl2(g) ![]() PCl5(g),压缩体积,平衡正向移动,K值增大
PCl5(g),压缩体积,平衡正向移动,K值增大
D. 25℃时Ka(HClO)=3.0×10-8,Ka(HCN)=4.9×10-10,若该温度下NaClO溶液与NaCN溶液pH相同,则c(NaClO)<c(NaCN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各情况,在其中Fe片腐蚀由慢到快的顺序是
A.(5)(2)(1)(3)(4) B.(5)(1)(2)(4)(3)
C.(4)(2)(1)(3)(5) D.(4)(3)(1)(2)(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列现象或事实的解释正确的是![]()
选项 | 现象或事实 | 解释 |
A | 用热的纯碱溶液洗去油污 |
|
B | 漂白粉在空气中久置变质 | 漂白粉中的 |
C | 施肥时,草木灰 |
|
D | 钢铁在潮湿的空气中容易生锈 | 钢铁在空气中发生了析氢腐蚀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修2:化学与技术]海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河人海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和________池。
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜 只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用_______(写一点即可)。
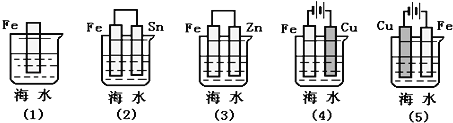
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。
①海水不能直接通入到阴极室中,理由是______________.
②A口排出的是_______(填“淡水”或“浓水”)。
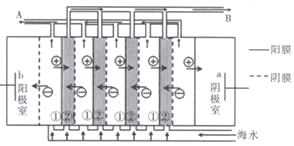
(3)用苦卤(含 Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:
①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为___________。
②通过苦卤中通入Cl2已获得含溴的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液________。
③向蒸馏塔中通入水蒸气加热,控制温度在90![]() 左右进行蒸馏的原因是___________。
左右进行蒸馏的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,向![]() 的
的![]() 溶液中滴加
溶液中滴加![]() 的稀硫酸,溶液由黄色转变成橙红色的
的稀硫酸,溶液由黄色转变成橙红色的![]() ,溶液中水
,溶液中水![]() 增大,在此转化过程中,各物质的量浓度变化如图所示.下列说法正确的是
增大,在此转化过程中,各物质的量浓度变化如图所示.下列说法正确的是![]()

A.向以上反应加入一定量的![]() 溶液,对平衡几乎没有影响
溶液,对平衡几乎没有影响
B.升高温度,混合溶液的颜色逐渐加深
C.该反应的离子方程式为:![]()
D.该反应的化学平衡常数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com