
【题目】S-诱抗素的分子结构如图。下列关于该物质的说法正确的是
![]()
A.该有机物能发生取代、加成和水解反应B.1mol该有机物与足量溴反应最多消耗4mol Br2
C.该有机物的分子式为C15H21O4D.1mol该有机物与足量Na反应生成生成1mol H2
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】已知氢硫酸(H2S) 的电离平衡常数为: Ka1(H2S)=9.1×10—8, Ka2(H2S)=1.1×10 -12。H2S溶液中c(总)=c(H2S)+c(HS— )+c(S2— )。室温下向25.00 mL 0.1000 mol·L—1 'H2S 溶液中逐滴滴入NaOH溶液。下列说法正确的是
A.随着NaOH溶液滴入,溶液中水的电离程度不断增大
B.c(Na+ )=c(总)的溶液: c(Na +)>c(S2—)> c(H2S)> c(H+)
C.pH=7的溶液: c(Na+)>c(S2—)>c(HS— )>c(OH— )=c(H+)
D.c(H+)=9.1×10-8 mol·L-1时: c(H2S)+2c(S2— )+c(OH— )=c(Na + )+c(H— )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的有几个( )
(1)强电解质溶液的导电能力不一定比弱电解质溶液强
(2)将氢氧化钠溶液和氨水各稀释一倍,氢氧根浓度均减小为原来的—半
(3)如果盐酸的浓度是醋酸浓度的2倍,则盐酸的氢离子浓度也是醋酸的2倍
(4)减少反应物的用量,平衡一定逆向移动
(5)离子化合物一定是电解质
(6)非电解质的水溶液一定不能导电
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25℃时,0.1 mol/L的氨水。请回答下列问题:
(1)若向0.1 mol·L-1氨水中加入少量硫酸铵固体,此时溶液中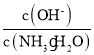 ____(填“增大”“减小”或“不变”)。
____(填“增大”“减小”或“不变”)。
(2)若向0.1mol·L-1氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol·L-1,则
c(SO42-)=_____________。
(3)若向0.1 mol·L-1氨水中加入pH=1的硫酸,且氨水与硫酸的体积比1:1,则所得溶液中各离子物质的量浓度由大到小的顺序是______________。
(4)将足量的AgCl固体分别放入: ①5mL水,②10mL 0.2mol·L-1MgCl2溶液,③20mL 0.5 mol·L-1 NaCI溶液,④40mL 0.1mol·L-1盐酸中溶解至溶液饱和,各溶液中Ag+的物质的量浓度分别为a、b、c、d,它们由大到小的排列顺序是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2·2H2O晶体,按如图步骤进行提纯:
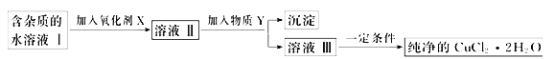
(1)最适合作氧化剂X的是_________(填字母),加入X的目的是______________。
A.K2Cr2O7B.NaClO C.H2O2D.KMnO4
加入的物质Y是____________(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=__________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。(I2+2S2O32-= S4O62-+2I-)
①可选用___________作滴定指示剂。
②CuCl2溶液与KI反应的离子方程式为________________。
③该试样中CuCl2·2H2O的质量百分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度为2 mol·L-1的盐酸V L,欲使其浓度变为4 mol·L-1,以下列出的方法中可行的是( )
A. 通入标准状况下的HCl气体44.8 L
B. 将溶液加热蒸发浓缩至0.5V L
C. 蒸发掉0.5V L水
D. 加入10 mol·L-1盐酸0.6V L,再将溶液稀释至2V L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是
A. 0.2mol·L-1Na2SO4溶液中含有Na+和SO42—总物质的量为0.6mol
B. 50mL 2mol·L-1的NaCl溶液和100 mL L 0.5mol·L-1MgCl2溶液中,Cl-的物质的量浓度相等
C. 用1L水吸收22.4L氯化氢(标况下)所得盐酸的浓度是1mol·L-1
D. 10g 98%的硫酸(密度为1.84g·cm—3)与10mL 18.4mol·L—1的硫酸的浓度是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为某实验小组依据氧化还原反应(用离子方程式表示)________设计的原电池装置。反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。

(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= - 24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H= - 47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:__________。
(3)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。该反应通常用V2O5作催化剂,加V2O5会使图中B点_________ (填“升高”还是“降低”),△H______(填“变大”、“变小”或“不变”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2 p1>p2 m+n>p 放热反应B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com