
【题目】已知氢硫酸(H2S) 的电离平衡常数为: Ka1(H2S)=9.1×10—8, Ka2(H2S)=1.1×10 -12。H2S溶液中c(总)=c(H2S)+c(HS— )+c(S2— )。室温下向25.00 mL 0.1000 mol·L—1 'H2S 溶液中逐滴滴入NaOH溶液。下列说法正确的是
A.随着NaOH溶液滴入,溶液中水的电离程度不断增大
B.c(Na+ )=c(总)的溶液: c(Na +)>c(S2—)> c(H2S)> c(H+)
C.pH=7的溶液: c(Na+)>c(S2—)>c(HS— )>c(OH— )=c(H+)
D.c(H+)=9.1×10-8 mol·L-1时: c(H2S)+2c(S2— )+c(OH— )=c(Na + )+c(H— )
【答案】D
【解析】
A.H2S是二元弱酸,在溶液中抑制水的电离,向25.00 mL 0.1000 mol·L—1H2S溶液中逐滴滴入NaOH溶液,H2S与NaOH反应生成NaHS、Na2S时,反应生成的NaHS、Na2S水解,促进水的电离,溶液中水的电离程度不断增大,当H2S完全反应,再滴入NaOH溶液,溶液中过量的NaOH抑制水的电离,水的电离程度会减小,故A错误;
B.c(Na+ )=c(总)的溶液为NaHS溶液,NaHS的水解常数Kh=![]() => Ka2=1.1×10 -12,溶液中NaHS的水解程度大于电离程度,NaHS溶液呈碱性, 溶液中c(H2S)> c(S2-),故B错误;
=> Ka2=1.1×10 -12,溶液中NaHS的水解程度大于电离程度,NaHS溶液呈碱性, 溶液中c(H2S)> c(S2-),故B错误;
C.因NaHS溶液呈碱性,pH=7的溶液为H2S与NaHS的混合溶液,则溶液中c(HS- )> c(S2-),故C错误;
D.由K a1=![]() =9.1×10-8可知c(H+)=9.1×10-8 mol·L-1时,溶液中c(H2S)= c(HS- ),由电荷守恒c(HS- ) +2c(S2- )+c(OH- )=c(Na + )+c(H- )可得c(H2S)+2c(S2- )+c(OH- )=c(Na + )+c(H- ),故D正确;
=9.1×10-8可知c(H+)=9.1×10-8 mol·L-1时,溶液中c(H2S)= c(HS- ),由电荷守恒c(HS- ) +2c(S2- )+c(OH- )=c(Na + )+c(H- )可得c(H2S)+2c(S2- )+c(OH- )=c(Na + )+c(H- ),故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】25℃时,三种酸的电离平衡常数如下表所示。
化学式 | CH3COOH | HClO | H3PO3 |
名称 | 醋酸 | 次氯酸 | 亚磷酸 |
电离平衡常数 | 1.8×10-5 | 3.0×10-8 | K1=8.3×10-3 K2 =5.6×10-6 |
回答下列问题:
(1)浓度均为0.1 molL-1的CH3COOH 、HClO 、H3PO3溶液中,c(H+)最小的是_____________。
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性。H3PO3的第二级电离方程式为________________。Na2HPO3是_____________(填“酸式盐”“碱式盐”或“正盐”)。
(3)常温下,0.1 molL-1的CH3COOH溶液加水稀释的过程中,下列表达式的数值变大的是______(填字母)。
A.c(H+) B.  C.c(CH3COO-) D.c(CH3COOH)
C.c(CH3COO-) D.c(CH3COOH)
(4)体积均为10mL、c(H+)均为10-2 mol L-1的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中c(H+)的变化如图所示,则HX的电离平衡常数_______________(填“大于”“ 小于”或“等于”)醋酸的电离平衡常数,理由是____________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的相关表述中正确的是
A. 因H+(aq) +OH- (aq)==H2O(l) △H=-akJ·mol-1,故1molNaOH固体与足量的稀盐酸反应,放出的热量为akJ
B. 因CuSO4·5H2O(s)==CuSO4(s)+5H2O(1)△H=+bkJ·mol-1,故1molCuSO4(s)溶于水时,放出的热量为bkJ
C. 因氢气的燃烧热为c kJ·mol-1,故水电解的热化学方程式为2H2O (l)==2H2(g)+O2(g) △H=+c kJ·mol-1
D. 因N2(g)+3H2(g)![]() 2NH3(g) △H=-d kJ·mol-1,故在某容器中通入1molN2与3molH2充分反应后,放出的热量小于dkJ
2NH3(g) △H=-d kJ·mol-1,故在某容器中通入1molN2与3molH2充分反应后,放出的热量小于dkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定烧碱的纯度,进行以下滴定操作:
A.在250mL容量瓶中定容成250mL烧碱溶液
B.用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴酚酞指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为M mol·L-1的标准HCl溶液装入酸式滴定管,调整液面,记下开始刻度数为V1mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点酸的体积V2mL
回答下列问题:
(1)正确的操作步骤的顺序是(用字母填写)________→________→________→D→________
(2)使用滴定管之前应进行的操作是________
(3)操作E中的锥形瓶下垫一张白纸的作用是________
(4)若酸式滴定管未用盐酸标准溶液润洗,会对测定结果有何影响________(填“偏高”、“偏低”或“无影响”)
(5)该烧碱样品的纯度计算式________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中会产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2)。利用废玻璃粉末可以制取多种化工产品。设计流程如下:

查阅资料可知:
①CeO2性质:淡黄或黄褐色粉末,不溶于水和碱,微溶于酸;有强氧化性。
②Ce3+在碱金属碳酸盐溶液中生成难溶的碳酸复盐Ce2(CO3):Na2CO3·2H2O。
③常温时两种沉淀物的溶度积见表:
沉淀物 | Fe(OH)3 | Ce(OH)3 |
Ksp | 4.0×10-38 | 1.5×10-20 |
回答下列问题:
(1)过程①分离操作中用到的玻璃仪器有_______________________________。
(2)过程④中发生反应的离子方程式为_________________________________,过程⑥中发生的化学反应方程式为__________________________________。
(3)产品I是一种新型、绿色的多功能净水剂,集氧化、灭菌、消毒、吸附、絮凝、沉淀等性能为一体。净水过程中,Na2FeO4 起到吸附、絮凝作用的原理是_________________。
(4)工业上也可用电解浓NaOH溶液制备产品I。用铁做电极,写出电解时阳极发生的电极反应方程式_________________。
(5)沉淀过程中,当某种离子浓度降至10—5 mol·L-1时,可认为此离子完全沉淀。过程②中Fe3+沉淀完全时溶液的pH=_____ (已知 lg2=0.3)。
(6)写出产品III的一种用途______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年第26届国际计量大会(CGPM)对国际单位制进行了修改,将阿伏加德常数变为了精确数值,用原子来定义千克。研究者们使用激光测量“硅球"球体点阵中一个晶格单位的长度和硅原子的平均直径,从而确定一定 质量的纯硅球体中准确的原子数。
(1)基态硅原子的核外电子排布式是_____________________。基态的气态原子失去一个电子形成气态一价正离子时所需能量称为元素的第一电离能(I1),元素气态一价正离子失去一个电子形成气态二价正离子时所需能量称为元素的第二电离能(I2),…… .以此类推。下列电离能比值最大的是_____________
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
(2)晶体硅具有金刚石型结构,其中硅原子的杂化方式是_______,晶体硅中硅原子与σ键的数目比是___________。
(3)组成为Na2O·Al2O3·2SiO2·nH2O的铝硅酸盐是一种常见的分子筛。O、Al、Si 电负性
由小到大的顺序是___________________。
(4)硅与碳是同主族元素,碳原子与碳原子之间可以形成单键、双键和三键,但硅原子之间却不容易形成双键和三键,原因是________________________。
(5)硅晶胞结构如图所示,则晶胞中含有___个硅原子。 硅晶体的密度为ρ gcm—3,硅的摩尔质量为 M g·mol-1, 经测定,晶胞边长为a pm,则阿伏加德罗常数可表示为:NA=__mol—1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置图及实验用品均正确的是![]() 部分夹持仪器未画出)( )
部分夹持仪器未画出)( )
A.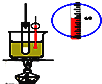 实验室制硝基苯
实验室制硝基苯
B.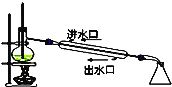 石油分馏
石油分馏
C.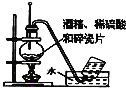 实验使用经酒精制取乙烯
实验使用经酒精制取乙烯
D.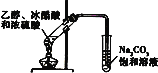 实验室制乙酸乙酯
实验室制乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础。关于下列各实验装置图的叙述中正确的是( )
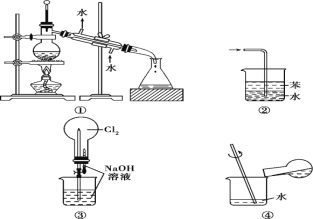
A. 装置①常用于分离互不相溶的液态混合物
B. 装置②可用于吸收氨气,且能防止倒吸
C. 用装置③不可以完成“喷泉”实验
D. 用装置④稀释浓硫酸和铜反应冷却后的混合液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S-诱抗素的分子结构如图。下列关于该物质的说法正确的是
![]()
A.该有机物能发生取代、加成和水解反应B.1mol该有机物与足量溴反应最多消耗4mol Br2
C.该有机物的分子式为C15H21O4D.1mol该有机物与足量Na反应生成生成1mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com