
【题目】下列实验装置图及实验用品均正确的是![]() 部分夹持仪器未画出)( )
部分夹持仪器未画出)( )
A.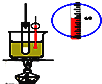 实验室制硝基苯
实验室制硝基苯
B.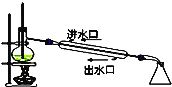 石油分馏
石油分馏
C.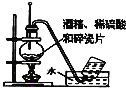 实验使用经酒精制取乙烯
实验使用经酒精制取乙烯
D.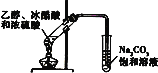 实验室制乙酸乙酯
实验室制乙酸乙酯
【答案】A
【解析】
A.制备硝基苯,需浓硫酸与浓硝酸的混和酸,此反应为放热反应,而苯和浓硝酸都是易挥发物质,因此要设计冷凝装置,在50~60℃下发生反应,因此需水浴装置,需温度计测量反应的温度,A正确;
B.冷凝时,水需充满冷凝器,为了防止冷凝器冷凝时,受热不均匀破裂,冷凝水应下进上出,石油分馏温度计测量蒸汽的温度,温度计水银泡在支管口出,B错误;
C.实验室制乙烯,需浓硫酸和乙醇加热到170℃,否则温度过低生成副产物乙醚,温度过高,乙烯被氧化,所以温度计应在混合液中,C错误;
D.实验室制备乙酸乙酯时,加热不均匀易造成Na2CO3溶液倒流进加热反应物的试管中,导致试管破裂,由于混合物中含有乙醇和乙酸,易溶于水,易生产倒吸,实验时导管不能插入到液面以下,D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】下列说法中,与盐类水解有关的是( )
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,将FeCl3溶于少量的浓盐酸再加水稀释;
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤草木灰与铵态氮肥不能混合施用;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性.
A. ①④⑥ B. ②③⑤ C. ③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氢硫酸(H2S) 的电离平衡常数为: Ka1(H2S)=9.1×10—8, Ka2(H2S)=1.1×10 -12。H2S溶液中c(总)=c(H2S)+c(HS— )+c(S2— )。室温下向25.00 mL 0.1000 mol·L—1 'H2S 溶液中逐滴滴入NaOH溶液。下列说法正确的是
A.随着NaOH溶液滴入,溶液中水的电离程度不断增大
B.c(Na+ )=c(总)的溶液: c(Na +)>c(S2—)> c(H2S)> c(H+)
C.pH=7的溶液: c(Na+)>c(S2—)>c(HS— )>c(OH— )=c(H+)
D.c(H+)=9.1×10-8 mol·L-1时: c(H2S)+2c(S2— )+c(OH— )=c(Na + )+c(H— )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.Fe(OH)3溶于氢碘酸(HI):Fe(OH)3+3H+=Fe3++3H2O
B.少量铁粉投入足量的稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O
C.向FeBr2溶液中通入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.向FeI2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纳米Fe/Ni复合材料能去除污染水体的NO3-,Ni不参与反应。离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢(NH4+无法占据活性位点)。反应过程如图所示:
(1)酸性环境中,纳米Fe/Ni去除NO3-分两步,将步骤ii补充完整:
Ⅰ.NO3-+Fe+2H+=NO2-+Fe2++H2O
Ⅱ.___+___+___H+=___Fe2++___+___
(2)初始pH=2.0的废液反应15min后,出现大量白色絮状物,过滤后很快变成红褐色,结合化学用语解释整个变化过程的原因___。
(3)水体初始pH会影响反应速率,不同pH的硝酸盐溶液与纳米Fe/Ni反应时,溶液中![]() 随时间的变化如图1所示。(注:c0(NO3-)为初始时NO3-的浓度。)
随时间的变化如图1所示。(注:c0(NO3-)为初始时NO3-的浓度。)

①为达到最高去除率,应调水体的初始pH=___。
②t<15min,pH=2.0的溶液反应速率最快,t>15min,其反应速率迅速降低,原因分别是___。
(4)总氮量指溶液中自由移动的所有含氮微粒浓度之和,纳米Fe/Ni处理某浓度硝酸盐溶液时,随时间的变化如图2所示。40min时总氮量较初始时下降,可能的原因是___。

(5)利用电解无害化处理水体中的NO3-,最终生成N2逸出。其装置及转化图如图所示:
①阴极的电极反应式为___。
②生成N2的离子方程式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的有几个( )
(1)强电解质溶液的导电能力不一定比弱电解质溶液强
(2)将氢氧化钠溶液和氨水各稀释一倍,氢氧根浓度均减小为原来的—半
(3)如果盐酸的浓度是醋酸浓度的2倍,则盐酸的氢离子浓度也是醋酸的2倍
(4)减少反应物的用量,平衡一定逆向移动
(5)离子化合物一定是电解质
(6)非电解质的水溶液一定不能导电
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是
A. 0.2mol·L-1Na2SO4溶液中含有Na+和SO42—总物质的量为0.6mol
B. 50mL 2mol·L-1的NaCl溶液和100 mL L 0.5mol·L-1MgCl2溶液中,Cl-的物质的量浓度相等
C. 用1L水吸收22.4L氯化氢(标况下)所得盐酸的浓度是1mol·L-1
D. 10g 98%的硫酸(密度为1.84g·cm—3)与10mL 18.4mol·L—1的硫酸的浓度是相同的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com