
【题目】下列离子方程式书写正确的是( )
A.Fe(OH)3溶于氢碘酸(HI):Fe(OH)3+3H+=Fe3++3H2O
B.少量铁粉投入足量的稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O
C.向FeBr2溶液中通入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.向FeI2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列溶液,一定呈中性的是
A. 由等体积、等物质的量浓度的硫酸跟NaOH溶液混合后所形成的溶液
B. c(H+)=1.0×10-7mol·L-1的溶液
C. pH=7的溶液
D. c(H+)=![]() 的溶液(Kw为该温度下水的离子积常数)
的溶液(Kw为该温度下水的离子积常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积固定的2L的密闭容器中,一定量的SO2与1mol O2在催化剂作用下加热到600℃发生反应:2SO2+O2![]() 2SO3;△H<0。当气体的物质的量减少0.2mol时反应达到平衡,在相同的温度下测得气体压强为反应前的8/9。下列有关叙述正确的是( )
2SO3;△H<0。当气体的物质的量减少0.2mol时反应达到平衡,在相同的温度下测得气体压强为反应前的8/9。下列有关叙述正确的是( )
A. 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B. 降低温度,正反应速率减小程度比逆反应速率减小程度大
C. 将生成物SO3通入过量BaCl2溶液中,得到沉淀的质量为233g
D. 达到平衡时,平衡常数为2.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中会产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2)。利用废玻璃粉末可以制取多种化工产品。设计流程如下:

查阅资料可知:
①CeO2性质:淡黄或黄褐色粉末,不溶于水和碱,微溶于酸;有强氧化性。
②Ce3+在碱金属碳酸盐溶液中生成难溶的碳酸复盐Ce2(CO3):Na2CO3·2H2O。
③常温时两种沉淀物的溶度积见表:
沉淀物 | Fe(OH)3 | Ce(OH)3 |
Ksp | 4.0×10-38 | 1.5×10-20 |
回答下列问题:
(1)过程①分离操作中用到的玻璃仪器有_______________________________。
(2)过程④中发生反应的离子方程式为_________________________________,过程⑥中发生的化学反应方程式为__________________________________。
(3)产品I是一种新型、绿色的多功能净水剂,集氧化、灭菌、消毒、吸附、絮凝、沉淀等性能为一体。净水过程中,Na2FeO4 起到吸附、絮凝作用的原理是_________________。
(4)工业上也可用电解浓NaOH溶液制备产品I。用铁做电极,写出电解时阳极发生的电极反应方程式_________________。
(5)沉淀过程中,当某种离子浓度降至10—5 mol·L-1时,可认为此离子完全沉淀。过程②中Fe3+沉淀完全时溶液的pH=_____ (已知 lg2=0.3)。
(6)写出产品III的一种用途______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是
①CH3CH=CH2+Br2![]() CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
③CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3![]() C6H5NO2+H2O
C6H5NO2+H2O
A. ①②B. ③④C. ①③D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置图及实验用品均正确的是![]() 部分夹持仪器未画出)( )
部分夹持仪器未画出)( )
A.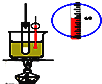 实验室制硝基苯
实验室制硝基苯
B.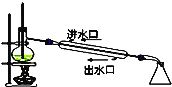 石油分馏
石油分馏
C.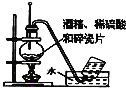 实验使用经酒精制取乙烯
实验使用经酒精制取乙烯
D.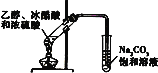 实验室制乙酸乙酯
实验室制乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4是一种补血剂,常温下久置易变黄,一般认为是二价铁被氧化为三价铁的缘故。
(1)已知:①Fe2+(aq)-e-= Fe3+(aq) △H1=akJ/mol
②O2(g)+4 e-+4H+(aq)=2H2O(l) △H2=bkJ/mol
则FeSO4在酸性溶液中变质的热化学方程式为_____ 。
常温下,配制浓度为0.1mol/L的FeSO4溶液,研究不同 pH 对Fe2+ 氧化的影响,结果如下图所示,(假设反应过程中溶液体积不变)。

(2)在pH=5.5的环境下,该反应在0~15min的平均速率v(Fe2+)=_______;增大溶液pH,Fe2+被氧化速率_______(填“增大”、“减小”或“无影响”)。
(3)在平衡常数的计算中气态物质常以压强代替其浓度,Fe2+在酸性环境下氧化的平衡常数K的计算表达式是______;常温下该反应的平衡常数很大,为2.5×1032L4 /(atmmol4),下列说法正确的是_______。
a. Fe2+转化为Fe3+的趋势大 b. Fe2+转化为Fe3+的速率大
c. 反应进行得较为彻底 d. 酸性条件下Fe2+不会被氧化
(4)在pH=13的环境下,Fe2+的氧化变质可以理解为:
第一步: Fe2++2OH-= Fe(OH)2,第二步_____________ (用化学方程式回答);当氧化达到平衡时,c(Fe2+)/ c(Fe3+)_____4.0×1022(填“>”“<”或“=”)。已知的Ksp[Fe(OH)3]=2.5×10-39,Ksp[Fe(OH)2]=1.0×10-15。
(5)根据上述分析,配制FeSO4溶液的正确方法是加入适量的铁粉和_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:

回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。

(3)步骤③中选用足量的H2O2,理由是_________________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法中正确的是( )
A.标准状况下,22.4 L氯气通入1 L水中转移的电子数为NA
B.标准状况下,11.2 L SO3所含的原子数为2NA
C.1 mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
D.15.6 g Na2S和Na2O2的混合物中含有的阴离子数等于0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com