
【题目】某研究学习小组要制备一种在水中溶解度很小的黄色化合物[Fex(C2O4)y·zH2O],并用滴定法测定其组成。已知H2C2O4在温度高于90℃时易发生分解。实验操作如下:
步骤一:将图甲分液漏斗中的草酸溶液滴入锥形瓶内,可生成黄色沉淀;
步嶸二:称取黄色产物0.841g于锥形瓶中,加入足量的硫酸并水浴加热至70~85℃。待固体全部溶解后,用胶头滴管吸岀一滴溶液点在点滴板上,用铁氰化钾溶液检验,无蓝色沉淀产生;
步骤三:用0.080mol/ LKMnO4标准液滴定步骤二所得的溶液;
步骤四:向步骤三滴定后的溶液中加足量的Zn粉和硫酸溶液,几分钟后用胶头滴管吸岀一滴点在点滴板上,用KSCN溶浟检验,若不显红色,过滤除去Zn粉,并用稀硫酸洗涤Zn粉,将洗涤液与滤液合并,用0.0800mol/ L KMnO4标准液滴定,用去髙锰酸钾标准液10.00mL。
(1)步骤一中将沉淀从反应混合物中分离出来的操作名称是__________________。
(2)步骤二中水浴加热并控制温度70~85℃的理由是__________________,加铁氰化钾溶液无蓝色沉淀产生,此操作的目的是__________________。
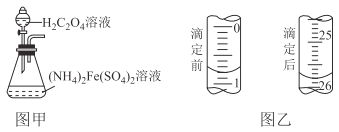
(3)步骤三盛装KMnO4标准液的滴定管在滴定前后的液如图乙所示,则消耗KMnO4标准液的体积为__________________,该滴定管为_________滴定管(填“酸式”或“碱式”)
(4)步骤四中滴定时发生反应的离子方程式为___________________________。若不合并洗涤液,则消耗KMnO4标准液的体积将_________(填“增大”“减小”或“不变”)。由以上数据计算黄色化合物的化学式为__________________。
【答案】过滤 加快固体溶解,同时防止草酸分解 铁氰化钾检验Fe2+的存在,防止Fe2+干扰草酸的测定 25.00mL 酸式 MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O 减小 Fe4(C2O4)5·10H2O
【解析】
步骤一草酸和(NH4)2Fe (SO4)2反应生成黄色固体[Fex(C2O4)y·zH2O],步骤二加硫酸溶解后,检验无二价铁离子,则说明含有Fe3+,步骤三用高锰酸钾滴定草酸根离子,步骤四将Fe3+还原成Fe2+,再用高锰酸钾滴定,确定铁离子的含量,进而进一步分析计算。
(1)分离固体和液体的操作是过滤;
故答案为:过滤;
(2) 由于H2C2O4在温度高于90℃时易发生分解,所以需要水浴加热并控制温度70~85℃,同时加快固体溶解。铁氰化钾检验Fe2+的存在,防止Fe2+干扰草酸的测定;
故答案为:加快固体溶解,同时防止草酸分解;氰化钾检验Fe2+的存在,防止Fe2+干扰草酸的测定;
(3)从图片中读出,消耗高锰酸钾的体积为:25.80mL-0.80mL=25.00mL;滴定液是高锰酸钾标准溶液,该溶液有强氧化性,只能选用酸式滴定管;
故答案为:25.00mL,酸式;
(4)步骤四是高锰酸钾滴定Fe2+,离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;洗涤液中残留少许Fe2+,若不合并洗涤液,则消耗KMnO4标准液的体积将减少;根据离子方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,可知关系MnO4-——5Fe2+,其中n(MnO4-)=0.0800mol/L×0.01L=0.0008mol,即n(Fe2+)=0.0008mol×5=0.0040mol,则样品中n(Fe)=0.0040mol。步骤三中,根据方程式:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O可得到转化关系:2KMnO4——5H2C2O4,即n(H2C2O4)=![]() n(KMnO4)=0.0800mol/L×0.025L×5/2=0.005mol,则样品中含草酸根的物质的量为0.005mol。根据质量守恒定律可知,0.841g样品中结晶水的物质的量为(0.841g-0.0040×56g-0.005×88g)/18g/mol=0.01mol,则n(Fe):n(C2O42-):n(H2O)=4:5:10,故黄色物质化学式为Fe4(C2O4)5·10H2O。
n(KMnO4)=0.0800mol/L×0.025L×5/2=0.005mol,则样品中含草酸根的物质的量为0.005mol。根据质量守恒定律可知,0.841g样品中结晶水的物质的量为(0.841g-0.0040×56g-0.005×88g)/18g/mol=0.01mol,则n(Fe):n(C2O42-):n(H2O)=4:5:10,故黄色物质化学式为Fe4(C2O4)5·10H2O。
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,减小,Fe4(C2O4)5·10H2O。


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】化学已渗入我们的“衣、食、住、行、医”中。
(1)衣:区分羊毛线和棉纱线的方法是灼烧,羊毛线燃烧食能闻到__________气味。
(2)食:维生素C能增强人体对疾病的抵抗能力,中学生每天要补充60mg的维C。下列物质富含维生素C的是 ________![]() 填字母
填字母![]() 。
。
A.橙子 ![]() 猪肉
猪肉 ![]() 面粉
面粉
(3)住:下列属于直接利用太阳能辐射能加热物体而获得热能的是 ________![]() 填字母
填字母![]() 。
。
A.石蜡燃烧 ![]() 太阳能热水器
太阳能热水器 ![]() 燃料电池
燃料电池
(4)行:城市交通中大力推广新能源汽车对于改善空气质量的好处是 _______________
A.增加新型污染 ![]() 浪费电能
浪费电能 ![]() 减少空气污染
减少空气污染
(5)医:出现低血糖症状时需要尽快补充葡萄糖,葡萄糖的化学式是________。
(6)淀粉和纤维素是两种重要的多糖,这两种物质________![]() 填“能”或“不能”
填“能”或“不能”![]() 互称为同分异构体,淀粉遇到______显蓝色。
互称为同分异构体,淀粉遇到______显蓝色。
(7)发育出现障碍,患营养缺乏症,这主要是由摄入蛋白质不足引起的,蛋白质在人体内水解的最终产物是________;向蛋白质溶液中加入![]() 溶液会出现白色沉淀,该变化叫作________。
溶液会出现白色沉淀,该变化叫作________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO、NO2是大气污染物,但只要合理利用也是重要的资源。
(1)NH3还原法可将NO2还原为N2进行脱除。
已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H1=-1530 kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H2=+180 kJ·mol-1
写出NH3还原NO的热化学方程式:_________________________________________。
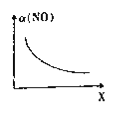
(2)亚硝酰氯(ClNO)是合成有机物的中间体。将一定量的NO与Cl2充入一密闭容器中,发生反应:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0。平衡后,改变外界条件X,实验测得NO的转化率a(NO)随X的变化如图所示,则条件X可能是________(填字母)。
2ClNO(g) △H<0。平衡后,改变外界条件X,实验测得NO的转化率a(NO)随X的变化如图所示,则条件X可能是________(填字母)。
a.温度 b.压强 c.![]() d.与催化剂的接触面积
d.与催化剂的接触面积
(3)在密闭容器中充入4 mol CO和5 mol NO,发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H1=-746.5 kJ·mol-1,图为平衡时NO的体积分数与温度、压强的关系曲线图。
N2(g)+2CO2(g) △H1=-746.5 kJ·mol-1,图为平衡时NO的体积分数与温度、压强的关系曲线图。
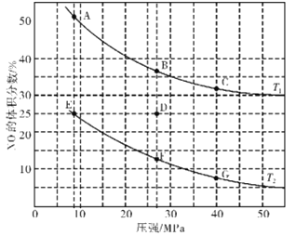
①温度:T1_______(填“<”或“>”)T2。
②若反应在D点达到平衡,此时对反应进行升温且同时扩大容器体积使平衡压强减小,重新达到平衡,则D点应向图中A~G点中的_______点移动。
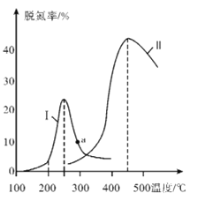
③某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。温度低于200℃时,图中曲线I脱氮率随温度升高而变化不大的主要原因为____________;a点_______(填“是”或“不是”)对应温度下的平衡脱氮率,说明其理由:___________________________________。
(4)以连二硫酸根(S2O42-)为媒介,使用间接电化学法处理燃煤烟气中的NO,装置如图4所示:

①阴极区的电极反应式为______________________________________。
②NO被吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上被吸收的NO在标准状况下的体积为____________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂解气用途广泛,可用于合成各种橡胶和医药中间体。利用石油裂解气合成CR橡胶和医药中间体K的线路如下:

已知:Ⅰ.氯代烃D的相对分子质量是113,氯的质量分数约为62.8%,核磁共振氢谱峰面积之比为2:1.
Ⅱ.  。
。
(1)A中官能团的结构式为__________________,D的系统名称是________________.
(2)反应②的条件是_____________,依次写出①和③的反应类型___________、_________.
(3)写出F→G过程中第一步反应的化学方程式____________________________.
(4)K的结构简式为____________________.
(5)写出比G多2个碳原子的同系物的所有同分异构体的结构简式_________________.
(6)已知双键上的氢原子很难发生取代反应。以A为起始原料,选用必要的无机试剂合成B_______。合成路线流程图示如下:
![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化亚铜(CuⅠ)是阳极射线管覆盖物,不溶于水和乙醇。下图是工业上由冰铜制取无水碘化亚铜的流程。
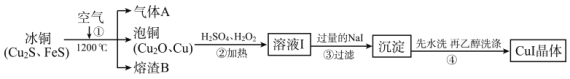
(1)FeS中S的化合价为_____________。
(2)步骤①中Cu2S被转化为Cu,同时有大气污染物A生成,相关化学反应方程式为_____________,熔渣B的主要成分为黑色磁性物质,其化学式为_____________。
(3)步骤②中H2O2的作用是_____________;步骤③中加入过量NaI涉及的主要离子反应方程式为_____________。
(4)步骤④用乙醇洗涤的优点是_____________;检验沉淀是否洗涤干净的方法是_____________。
(5)溶液I中通常含少量Fe(Ⅲ)。已知该工业条件下,Fe(OH)3的Ksp=1.0×10-38,据此分析除去Fe(Ⅲ)(即c(Fe3+)≤1.0×10-5mol/L)应调节pH不小于_____________(水的离子积以常温计)。
(6)准确称取 m g CuI样品,加入足量的Fe2(SO4)3溶液,发生反应为2CuⅠ+4Fe3+===2Cu2++4Fe2++I2,待样品完全反应后,用amol/L酸性KMnO4溶液滴定Fe(Ⅱ),消耗标准液的体积平均值为ⅴmL。样品中CuI的质量分数的计算表达式为_____________;如果滴定前,酸式滴定管没有用标准液润洗,CuI的质量分数_____________(填“偏低”、“偏高”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.235g核素![]() U发生裂变反应:
U发生裂变反应:![]() U+
U+![]() n
n![]()
![]() Sr+
Sr+![]() Xe+10
Xe+10![]() n,净产生的中子(
n,净产生的中子(![]() n)数为10NA
n)数为10NA
B.![]() Cl与
Cl与![]() Cl得电子能力相同
Cl得电子能力相同
C.中子数为146、质子数为92的铀(U)原子:![]() U
U
D.![]() U和
U和![]() U是中子数不同、质子数相同的同种核素
U是中子数不同、质子数相同的同种核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol/LNH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发)。下列说法不正确的是

A. M点溶液中水的电离程度比原溶液小
B. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
C. 随着NaOH的加入,  不断增大
不断增大
D. 当n(Na0H)=0.1mol时,c(Na+)=c(NH4+)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1 mol·L-1,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是

A. Ka(HA)=1×10-6
B. b点c(B+)=c(A-)=c(OH-)=c(H+)
C. a→c过程中水的电离程度始终增大
D. c点时,c(A-)/[c(OH-)c(HA)]随温度升高而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图完成一氧化氮与过氧化钠反应制备亚硝酸钠(2NO+Na2O2=2NaNO2,2NO2+Na2O2=2NaNO3,NO能被酸性KMnO4溶液氧化为NO3-),下列说法错误的是

A.检查装置气密性后,应先打开止水夹,从导管中通入N2
B.装置C是用来吸收CO2的
C.D管中可能含有的杂质为NaNO3、NaOH
D.装置E用于处理尾气,反应中氧化剂与还原剂的物质的量之比为1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com