
【题目】由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是( )
装置 |
|
|
|
现象 | 金属W不断溶解 | Y的质量增加 | W上有气体产生 |
A.装置甲中X作原电池正极
B.装置乙中Y电极上的反应式为Cu2++2e=Cu
C.装置丙中溶液的c(H+)不变
D.四种金属的活动性强弱顺序为Z>W>X>Y
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
A. 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-="==" Cl-+ ClO-+ H2O
B. 该消毒液的pH约为12:ClO-+ H2O![]() HClO+ OH-
HClO+ OH-
C. 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2↑+H2O
D. 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+CH3COO—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2X(g)+Y(g)![]() Z(g),某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
Z(g),某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
t/min | 2 | 4.5 | 5 | 6 |
X的转化率 | 30% | 40% | 70% | 70% |
A.随着反应的进行,混合气体的密度不断增大
B.反应在5.5min时,v正(X)=v逆(Z)
C.6min时,容器中剩余1.4 mol Y
D.若反应过程中,容器内压强不再改变,可以说明该反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列图象说法正确的是
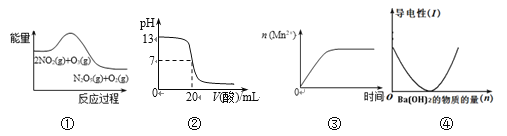
A. ①表示化学反应2NO2(g) + O3(g) = N2O5(g) + O2(g) ΔH > 0
B. ②表示25℃时,用0.1 mol/L CH3COOH溶液滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化
C. ③表示10 mL 0.01 mol/L酸性KMnO4溶液与过量的0.1 mol/L H2C2O4溶液混合时, n (Mn2+) 随时间的变化
D. ④可表示向稀硫酸溶液中滴加氢氧化钡溶液,溶液导电性随氢氧化钡物质的量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验内容、实验装置和对应的实验目的均正确的是
A. 测定中和热 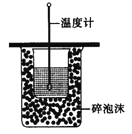
B. 比较Cu2+、Fe3+对反应速率的影响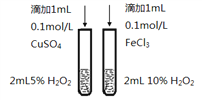
C. 比较醋酸和硼酸的酸性强弱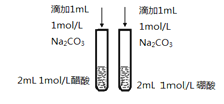
D. 比较温度对化学反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为____________。
②下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是_______(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液
c 加水稀释 d 加入少量醋酸钠晶体
(2)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
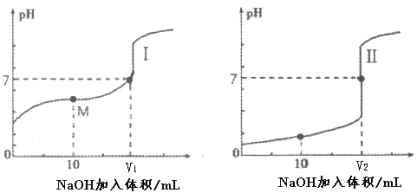
①滴定醋酸的曲线是___________(填“I”或“Ⅱ”)。
②滴定开始前,0.1 mol·L-1 NaOH、0.1 mol·L-1的盐酸和0.1 mol·L-1醋酸三种溶液中由水电离出的c(H+)最大的是_______溶液。
③图I中,V=10时,溶液中的c(H+)_________c(OH-) (填“>”、“=”或“<”,下同),c(Na+)_________c(CH3COO-)。
(3)下表为某同学所测25℃时,甲、乙两种溶液的pH。
甲 | 乙 | |
pH | 11 | 11 |
溶液 | 氨水 | 氢氧化钠溶液 |
①甲溶液中的c(OH-) =___________mol/L。
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸反应,消耗的盐酸体积:甲_____乙。
③甲、乙溶液均加水稀释10倍后,所得溶液的pH:甲_____乙。
(4)煤炭工业中经常会产生大量SO2,为防止污染环境,常采用吸收法进行处理。以下物质可用于吸收SO2的是____________。
A H2O2 B Na2CO3 C Na2SO3 D Ca(OH)2
(5)下表是几种常见弱酸的电离常数
化学式 | CH3COOH | H2SO3 | HClO | H2CO3 |
电离 常数 | 1.8×10-5 | K1=1.23×10-2 K2=6.6×10-8 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
/span>
以下反应对应的离子方程式正确的是___________。
A Na2CO3溶液吸收少量SO2:CO32-+SO2+H2O = SO32-+HCO3-
B 漂白液生效的原理:ClO-+CO2+H2O = HClO+HCO3-
C 次氯酸钠溶液吸收少量SO2:ClO-+SO2+H2O = HClO+SO32-
D 醋酸除水垢中的CaCO3:2CH3COOH+CaCO3 = Ca2++2CH3COO-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下甲醛是一种无色、有特殊刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确定的致癌物和致畸形物之一。我国规定:居室空气中甲醛的最高容许浓度为0.08mg/m3。某研究性学习小组设计用如下方法测定某居室空气中甲醛的含量(假设空气中无其他还原性气体):
(1)测定原理:KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸,反应的离子方程式为:
4MnO4-+ 5HCHO + 12H+ == 4Mn2+ + 5CO2↑+ 11H2O
2MnO4-+ 5H2C2O4 + 6H+ == 2Mn2++10CO2↑+ 8H2O
(2)测定装置:部分装置如图所示(a、b为止水夹)

(3)实验步骤:
① 检查装置气密性(气密性良好)。
② 用___________(填仪器名称)准确移取20.00 mL 2.00×10-3mol·L—1的高锰酸钾溶液(过量)于广口瓶中并滴入3滴6mol·L-1的H2SO4溶液备用。
③ 将2.00×10-3mol·L-1的草酸标准溶液置于_____________(填仪器名称)中备用。
④ 打开a,关闭b,用注射器抽取100mL新装修的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次(共5次)。如果压送气体时速度过快,可能会产生什么不利后果?___________。
⑤ 将广口瓶中的溶液转入锥形瓶中(润洗广口瓶2~3次,并将洗涤液全部转入锥形瓶)。如果没有润洗,所测甲醛的含量将_________(填“偏高”、“偏低”、“无影响”);
⑥ 用标准草酸溶液滴定锥形瓶中的溶液;记录滴定所消耗的草酸溶液体积。本实验是否需要指示剂?_________(填“是或否”),滴定终点时的实验现象为____________________。
⑦ 再重复实验2次。
(4)数据处理:分别于装修完工后的第1天、第7天、第30天(室内始终保持通风换气状况)对室内空气进行取样,通过实验测得以下三组数据(每次实验所取的KMnO4溶液均为 20.00mL):
装修后 第n天 | 草酸溶液(mL) | 甲醛的浓度 mg/m3 | |||
1 | 2 | 3 | 平均值 | ||
1 | 15.86 | 15.72 | 15.67 | 15.75 | |
7 | 26.17 | 26.36 | 26.38 | 26.27 | |
30 | 49.05 | 48.98 | 49.02 | 48.95 | |
设 KMnO4溶液的物质的量浓度为c1,KMnO4溶液的体积为v1(mL),草酸溶液的物质的量浓度为c2,草酸溶液的平均体积为v2(mL)则:计算室内空气中甲醛浓度(mg/m3)的代数式为__________(用c1、c2 、v1、v2表示),利用表中数据计算第30天室内空气中甲醛浓度为_______mg/m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种银白色的金属,常用于金属加工、电镀等。工业以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬及获得强氧化剂Na2Cr2O7。其工艺流程如图所示:
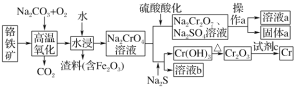
已知:高温氧化时发生反应Fe(CrO2)2+Na2CO3+O2→Na2CrO4+Fe2O3+CO2(未配平)
回答下列问题:
(1)将铬铁矿的主要成分Fe(CrO2)2写成氧化物的形式:__,高温氧化时可以提高反应速率的方法为___(写出一条即可)。
(2)Na2CrO4加入硫酸酸化的离子方程式为__;在实验室中,操作a所用到的玻璃仪器有__。
(3)Na2CrO4中铬元素化合价为__;生成1molNa2CrO4时共转移电子的物质的量为__mol。
(4)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1以下才能排放,可采用加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入硫酸处理多余的Ba2+的方法处理废水,加入可溶性钡盐后,废水中Ba2+的浓度应大于__mol·L-1,废水处理后达到国家标准才能排放。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同物质的量的下列有机物,充分燃烧,消耗氧气的量相同的是
A. C3H4和C2H6B. C3H6和C3H8O
C. C3H6O2和C3H8OD. C3H8O和C4H8O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com