
【题目】已知A、B、C、D、E、F、G七种短周期元素,其原子序数依次增大.A的质量数等于其质子数;B原子的最外层电子数是其电子层数的2倍;D的最外层电子数是其电子层数的3倍;E、F、G三种元素同周期且它们的最高价氧化物的水化物两两反应生成均盐和水,E、F、G的最外层电子数之和为10.回答下列问题。
(1)元素C、G的名称____,____;
(2)F元素在周期表中的位置____;
(3)以上七种元素能形成的最高价氧化物对应的水合物中酸性最强的为____(填化学式);
(4)D、E两元素形成的1:1的化合物的电子式____,其中含有的化学键的类型为____;用电子式表示A、C两元素组成中学化学最常见化合物的形成过程____;
(5)写出分别由A、D、E、G四种元素组成的两种化合物反应的离子方程式____;
【答案】 氮 硫 第三周期ⅢA族 H2SO4 ![]() 离子键与(非极性)共价键
离子键与(非极性)共价键 ![]() H++HSO3-=H2O+SO2↑
H++HSO3-=H2O+SO2↑
【解析】A、B、C、D、E、F、G七种元素为元素周期表中短周期元素,其原子序数依次增大.A的质量数等于其质子数,说明原子核内无中子,应为H元素;B原子的最外层电子数是其电子层数的2倍,为C元素;D的最外层电子数是其电子层数的3倍,为O元素,则C为N元素;E、F、G三种元素同周期且它们的最高价氧化物的水化物两两反应生成均盐和水,则F为Al,E为Na,E、F、G的最外层电子数之和为10,可知G的最外层电子数为10-1-3=6,为S元素;
(1)由分析可知元素C为氮元素、G为硫元素;
(2)Al元素在周期表中的位置第三周期ⅢA族;
(3)以上七种元素中硫元素非金属性最强,则其最高价氧化物对应的水合物中酸性最强的为H2SO4;
(4)离子化合物Na2O2的电子式为![]() ,其含有的化学键的类型为离子键与(非极性)共价键;用电子式表示NH3的形成过程为
,其含有的化学键的类型为离子键与(非极性)共价键;用电子式表示NH3的形成过程为![]() ;
;
(5)分别由H、O、Na、Al四种元素组成的NaHSO4和NaHSO3发生
反应的离子方程式为H++HSO3-=H2O+SO2↑。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】将H2、 N2、O2三种气体分别放入不同容器,使它们温度、密度相同,则其压强(p)大小的关系符合
A.p(H2)>p(O2)>p(N2) B.p(O2)>P(N2)>p(H2)
C.p(H2)>P(N2)>p(O2) D.P(N2)>p(O2)>p(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A. 碳酸氢钠可用于治疗胃酸过多的药物
B. 明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
C. 二氧化硫有漂白性,可以用来漂白食物
D. 常温下,用铁、铝制容器来盛装浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Al加入到氯化铁与硫酸铜的混合溶液中,下列不可能出现的阳离子组合
A. Al3+、Fe2+、Fe3+、Cu2+ B. Al3+、Fe2+、Cu2+
C. Al3+、Cu2+ D. Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150 mL 4 mol·L-1的稀硝酸,恰好使混合物完全溶解,放出2.24 L NO(标准状况),往所得溶液中加入KSCN溶液,溶液不呈红色。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A.0.21 mol B.0.25 mol
C.0.3 mol D.0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是
( )
A.牛油、纤维素和蛋白质都是天然高分子化合物
B.淀粉水解的最终产物是果糖
C.葡萄糖能发生氧化反应和水解反应
D.浓硝酸溅在皮肤上,使皮肤呈黄色是由于浓硝酸和蛋白质发生了颜色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备气体和验证气体性质的装置图,若利用该装置实现碳和浓硫酸的反应,并进行如下验证:
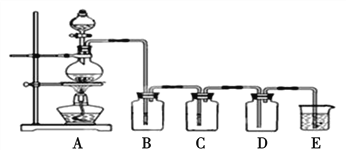
(1)实验步骤: 连接仪器、____、加药品后,然后滴入浓硫酸,加热。
(2)C与浓硫酸反应的化学方程式是____。
(3)若要证明产物中的两种气体,装置B、C、D、E中分别装有品红溶液、酸性KMnO4溶液、品红溶液、澄清石灰水,则B、D装置中品红溶液的作用分别是____,____。证明气体中有CO2的现象是____。
(4)若证明SO2具有氧化性,同时证明碳的非金属性比硅强,B、C、D中分别装有Na2S溶液、足量酸性KMnO4溶液、品红溶液。则:B中的现象为____;E中应加入____溶液(填化学式),现象为____,反应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,发生反应:
①M(s)+N(g) ![]() R(g) ΔH=-Q1 kJ·mol-1
R(g) ΔH=-Q1 kJ·mol-1
②2R(g)+N(g) ![]() 2T(g) ΔH=-Q2 kJ·mol-1
2T(g) ΔH=-Q2 kJ·mol-1
③M(g)+N(g) ![]() R(g) ΔH=-Q3 kJ·mol-1(已知Q1、Q2、Q3均为正值)下列说法正确的是( )
R(g) ΔH=-Q3 kJ·mol-1(已知Q1、Q2、Q3均为正值)下列说法正确的是( )
A.1 mol R(g)的能量总和大于1 mol M(s)与1 mol N(g)的能量总和
B.将2 mol R(g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ
C.当1 mol M(s)完全转化为T(g)时(假定无热量损失),放出热量(Q1+![]() ) kJ
) kJ
D.根据反应①和③可知Q3<Q1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com