
【题目】现有一瓶甲和乙的混合物,已知甲和乙的某些性质如下表所示:
物质 | 熔点/ ℃ | 沸点/ ℃ | 密度/ g·cm3 | 水中的溶解性 |
甲 | -98 | 57.5 | 0.93 | 可溶 |
乙 | -84 | 77 | 0.90 | 可溶 |
据此,将甲和乙互相分离的方法是
A. 蒸馏法 B. 升华法 C. 萃取法 D. 过滤法
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.1molN2可与3molH2完全反应生成2molNH3
B.所有铵盐受热均可以分解,其产物中都有氨
C.二氧化硅是人类将太阳能转换为电能的常用材料
D.工业合成氨的过程是人工固氮的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于下图所示的装置中进行中和热的测定实验。回答下列问题:

(1)从图中实验装置看,其中尚缺少的一种玻璃用品是______________,除此之外,装置中的一个明显错误是_____________________________。
(2)为保证该实验成功该同学采取了许多措施,如图的碎泡沫塑料的作用在于____________________________________。
(3)实验数据如下表:
①请填写下表中的空白:
温度 实验序号 | 起始温度t1(℃) | 终止温度t2(℃) | 温度差平均值 (t2-t1)(℃) | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___________ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为实验所用溶液的密度都是1 g/cm3,中和后溶液的比热容c=4.18 J/(g·℃)。根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式(计算结果保留一位小数):_______________。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(4)如果用含0.5mol Ba(OH)2的稀溶液与足量稀硫酸溶液反应,反应放出的热____57.3 kJ(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g) △H<0,在恒容的密闭容器中,下列有关说法正确的是
2N2(g)+3H2O(g) △H<0,在恒容的密闭容器中,下列有关说法正确的是
A. 平衡时,其他条件不变,升高温度可使该反应的速率加快,平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1∶2时 ,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________molL-1s-1,反应的平衡常数K1为_________

(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020molL-1s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是_____________________。
②列式计算温度T时反应的平衡常数K2 =________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______(填“正反应”或“逆反应”)方向移动,判断理由是__________________。
(4)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应2CH3OH(g)=CH3OCH3(g)) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H=____________ kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)常用于处理含硫废水。某学习小组在实验室中探究ClO2与Na2S的反应。
已知:① ClO2是极易溶于水的黄绿色气体,有毒,沸点为11℃。
② SO2 + NaClO3 + H2SO4→ ClO2 + NaHSO4(未配平)
③ ClO2 + NaOH→NaCl + NaClO3 + H2O(未配平)
请回答下列问题:
(1)设计如下装置制备ClO2

①装置A中反应的化学方程式为__________________________________。
②装置B中反应的氧化剂与还原剂的物质的量之比为___________。
③欲收集一定量的ClO2,选择上图中的装置,其连接顺序为a→g→h→_________________→d。
(2)探究ClO2与Na2S的反应
将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入如图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究Ⅰ中反应的产物
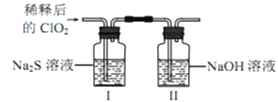
操作步骤 | 实验现象 | 结论 |
取少量Ⅰ中溶液放入试管甲中,滴加品红溶液和盐酸。 | 品红溶液始终不褪色 | ①无_______生成。 |
另取少量Ⅰ中溶液放入试管乙中,加入Ba(OH)2溶液和盐酸,振荡。 | ②___________ | 有SO42-生成 |
③继续在试管乙中加入Ba(OH)2溶液至过量,静置,取上层清液放入试管丙中,______________。 | 有白色沉淀生成 | 有Cl-生成 |
④ClO2与Na2S反应的离子方程式为_________________________________________。用于处理含硫废水时,ClO2相对于Cl2的优点是_____________________________________________(任写一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一位同学用托盘天平称量2.5g药品,在称量中发现指针向左偏转,这时他应该( )
A.减少药品B.向右盘中加砝码
C.移动游码D.调节天平的平衡螺母
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为得到相同物质的量的氯离子,等物质的量浓度的NaCl、MgCl2、AlCl3的体积比为
A. 6∶3∶2 B. 3∶2∶1
C. 1∶1∶1 D. 1∶2∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com