
【题目】下列说法中正确的是
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能够发生
C.反应物总能量大于生成物总能量的反应是吸热反应
D.反应物和生成物所具有的总能量的差决定了化学反应是放热还是吸热反应物
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是
A.铝与稀盐酸的反应
B.灼热的木炭与CO2反应
C.甲烷在氯气中的燃烧反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是某些无机物的转化关系(部分反应物和生成物未列出)。已知F是一种红褐色沉淀;M、K是常见的金属单质;B是一种有刺激性气味的气体;向C溶液中加入BaCl2溶液,生成不溶于稀盐酸的白色沉淀。
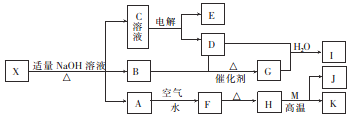
(1)已知盐X不带结晶水,则X的化学式为_________。
(2)若不考虑损失,G、D和H2O可恰好完全反应生成I,反应时G和D的物质的量之比为__________。
(3)足量K与I的稀溶液反应的离子方程式为____________________。
(4)J与NaOH溶液恰好完全反应可生成一种盐。将该盐的水溶液蒸干灼烧可得到_________(填化学式)。
(5)在0.02 mol·L-1的X溶液中,各种离子的浓度由大到小的顺序为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的鉴别,不能实现的是( )
A. 用双缩脲试剂可区分蛋白质溶液和淀粉溶液
B. 用水可区分苯,甲苯和溴苯
C. 用高锰酸钾酸性溶液可区分乙烷和乙烯
D. 用溴水可鉴别苯酚溶液,2-己烯和甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的值,下列叙述正确的是 ( )
A.78g过氧化钠晶体中,含2NA个阴离子
B.常温常压下,22.4L氦气含有NA个氦原子
C.在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA
D.常温下16g O2与O3的混合气体中含氧原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24L三氯甲烷中含有的共价键数目为0.4NA
B.常温常压下,7.8gNa2O2中含有阴离子的数目为0.1NA
C.1mol羟基与1mol氢氧根离子所含电子数均为9NA
D.在1.0L 0.1mol·L-1Na2CO3溶液中,阴离子总数小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期律的叙述正确的是( )
A. 同主族元素自上而下,金属性减弱
B. 同主族元素自上而下,得电子能力增强
C. 同周期元素中中ⅠA族元素的原子半径最小
D. 同周期元素中中ⅦA族元素气态氢化物最稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式的划时代的意义。请回答下列问题:
(1)无机非金属材料
高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
![]()
①写出步骤Ⅰ的化学方程式:____________________________。
②步骤Ⅱ经过冷凝得到的SiHCl3(沸点为33.0 ℃)中含有少量的SiCl4(沸点为57.6 ℃)和HCl(沸点为-84.7 ℃),提纯SiHCl3的实验方法是____________________________。
(2)磁性材料
这种材料一般含有铁元素,铁是用途最为广泛的金属,也较为活泼,所以从它的使用开始就不断实施对它的防护。最常见的铁制品腐蚀是电化学腐蚀,请写出最为普遍的电化学腐蚀的负极反应式:____________________________。
(3)激光材料
我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料,它是一种两性氧化物,请用离子方程式加以说明:______________________________。
(4)高分子材料
它可以分成无机高分子材料和有机高分子材料。一种新型高效净水剂[AlFe(OH)nCl6-n]m就属于无机高分子材料,它广泛应用于生活用水和工业污水的处理,其中铁元素的化合价为__________;一种合成纤维腈纶,又称“人造羊毛”,以丙烯腈(CH2===CH—CN)为原料聚合生成,请写出生成该有机高分子材料的化学方程式:________________________。
(5)合金材料
14 g铜银合金与一定量某浓度的硝酸完全反应后,将放出的气体与1.12 L(标准状况下)O2混合通入水中,恰好全部被水吸收,则合金中铜的质量为________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol /L H2A溶液中滴加0.2 mol /L NaOH溶液。有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示。根据图示判断,下列说法正确的是
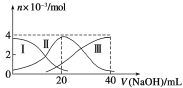
A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-) >c(H+) >c(OH-)
B.等浓度的NaOH溶液与H2A溶液按2∶1混合后,其溶液中水的电离程度比纯水大
C.NaHA溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A)
D.向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com