

| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) | |
| C. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| D. | 相同温度下,起始时向容器中充入2.0 mol PCl3 和2.0mol Cl2,达到平衡时,PCl3 的转化率小于80% |
分析 根据图知,250s、350s时n(PCl3)相等说明250s时该反应达到平衡状态,
A.v(PCl3)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.16-0}{2.0}}{50}$mol•L-1•s-1;
B.反应达到平衡时,n(PCl3)=0.20mol,根据方程式知,n(PCl5)=(1.0-0.20)mol=0.80mol,n(PCl3)=n(Cl2)=0.20mol,则c(PCl3)=c(Cl2)=$\frac{0.20mol}{2.0L}$=0.1mol/L,c(PCl5)=$\frac{0.80mol}{2.0L}$=0.4mol/L,
化学平衡常数K=$\frac{0.1×0.1}{0.4}$=0.025;
相同温度下,起始时c(PCl5)=$\frac{1.0}{2.0}$mol/L=0.5mol/L,c(PCl3)=c(Cl2)=$\frac{0.20mol}{2.0L}$=0.1mol/L,浓度商=$\frac{0.1×0.1}{0.5}$=0.02,浓度商小于K,则平衡正向移动;
C.升高温度,平衡向吸热反应方向移动;
D.相同温度下,起始时向容器中充入2.0 mol PCl3 和2.0mol Cl2,如果二者完全转化为PCl5,为2.0mol,增大压强平衡逆向移动,五氯化磷转化率降低.
解答 解:根据图知,250s、350s时n(PCl3)相等说明250s时该反应达到平衡状态,
A.v(PCl3)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.16-0}{2.0}}{50}$mol•L-1•s-1=0.0016mol•L-1•s-1,故A错误;
B.反应达到平衡时,n(PCl3)=0.20mol,根据方程式知,n(PCl5)=(1.0-0.20)mol=0.80mol,n(PCl3)=n(Cl2)=0.20mol,则c(PCl3)=c(Cl2)=$\frac{0.20mol}{2.0L}$=0.1mol/L,c(PCl5)=$\frac{0.80mol}{2.0L}$=0.4mol/L,
化学平衡常数K=$\frac{0.1×0.1}{0.4}$=0.025;
相同温度下,起始时c(PCl5)=$\frac{1.0}{2.0}$mol/L=0.5mol/L,c(PCl3)=c(Cl2)=$\frac{0.20mol}{2.0L}$=0.1mol/L,浓度商=$\frac{0.1×0.1}{0.5}$=0.02,浓度商小于K,则平衡正向移动,则反应达到平衡前v(正)>v(逆),故B正确;
C.升高温度,平衡向吸热反应方向移动,平衡时c(PCl3)=0.11mol•L-1>0.1mol/L,说明升高温度平衡正向移动,则正反应是吸热反应,△H>0,故C错误;
D.相同温度下,起始时向容器中充入2.0 mol PCl3 和2.0mol Cl2,如果二者完全转化为PCl5,为2.0mol,增大压强平衡逆向移动,五氯化磷转化率降低,三氯化磷转化率升高,根据B知,B中五氯化磷转化率=$\frac{0.20mol}{1.0mol}×100%$=20%,该条件下五氯化磷转化率小于20%,则三氯化磷转化率大于80%,故D错误;
故选B.
点评 本题考查化学平衡有关计算,侧重考查学生分析计算能力,利用浓度商和化学平衡常数关系确定反应方向,易错选项是CD.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 分离液态空气制氮气 | |
| B. | 闪电将空气中的N2转化成NO | |
| C. | 工业上合成氮 | |
| D. | 豆科植物将空气中的N2转化为化合态氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
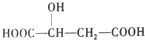 ,下列说法错误的是( )
,下列说法错误的是( )| A. | 1mol苹果酸可与2 molNaOH发生中和反应 | |
| B. | -定条件下,苹果酸与乙酸或乙醇均能发生酯化反应 | |
| C. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 | |
| D. | 1mol苹果酸与足量金属Na反应生成1.5 molH 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化铁溶液中滴加HI溶液:2Fe3++2HI═2Fe2++2H++I2 | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(0H)2恰好使反应完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4+AlO2-+2H2O | |
| C. | 1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合2AlO2-+5H+═Al(OH)3+Al3++H2O | |
| D. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小.
某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小. ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的烃有三种可能的结构 | |
| B. | 乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色 | |
| C. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| D. | 淀粉、纤维素和蛋白质都是高分子化合物,它们在一定条件下都能水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应停止了 | B. | 正反应速率与逆反应速率相等 | ||
| C. | 反应物和生成物浓度相等 | D. | 正反应速率与逆反应速率均为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入品红溶液或者溴水都能使它们褪色,均说明SO2具有漂白性 | |
| B. | 蘸有浓氨水和蘸有浓HNO3的玻璃棒靠近时有白烟产生,是因为氨气有还原性 | |
| C. | 某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,说明溶液中一定没有NH4+ | |
| D. | NH3•H2O的热不稳定性可以解释实验室中用加热氨水的办法制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
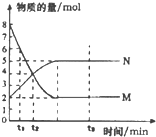
| A. | 反应式中a:b=2:5 | |
| B. | 0-t1物质M的浓度c(M)减少了1mol•L-1 | |
| C. | t2时,c(M)=c(N)=4mol•L-1,反应一定达到平衡状态 | |
| D. | t3时,c(M)不再变化,正反应速率小于逆反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com