
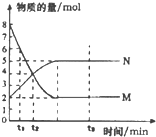
| A. | 反应式中a:b=2:5 | |
| B. | 0-t1物质M的浓度c(M)减少了1mol•L-1 | |
| C. | t2时,c(M)=c(N)=4mol•L-1,反应一定达到平衡状态 | |
| D. | t3时,c(M)不再变化,正反应速率小于逆反应速率 |
分析 A.根据图知,在反应中M的物质的量减少、N的物质的量增大,所以M是反应物、N是生成物,反应达到平衡状态时,△n(M)=(8-2)mol=6mol、△n(N)=(5-2)mol=3mol,同一时间段内各物质的物质的量变化量之比等于其计量数之比,所以M、N的计量数之比=6mol:3mol=2:1,所以反应方程式为2M(气)?N(气);
B.0-t1物质M的浓度c(M)减少了$\frac{8-6}{2}$mol•L-1;
C.t2时,c(M)=c(N)=2mol•L-1,该反应正逆反应速率不相等;
D.t3时,c(M)不再变化,该反应达到平衡状态.
解答 解:A.根据图知,在反应中M的物质的量减少、N的物质的量增大,所以M是反应物、N是生成物,反应达到平衡状态时,△n(M)=(8-2)mol=6mol、△n(N)=(5-2)mol=3mol,同一时间段内各物质的物质的量变化量之比等于其计量数之比,所以M、N的计量数之比=6mol:3mol=2:1,所以a:b=2:1,
故A错误;
B.0-t1物质M的浓度c(M)减少了$\frac{8-6}{2}$mol•L-1=1mol/L,故B正确;
C.t2时,c(M)=c(N)=2mol•L-1,根据图知,随着反应的进行,M的物质的量还在减少、N的物质的量还在增加,所以平衡向正反应方向移动,没有达到平衡状态,故C错误;
D.t3时,c(M)不再变化,该反应达到平衡状态,则正逆反应速率相等,故D错误;
故选B.
点评 本题考查图象分析,明确图象中曲线综合坐标含义及曲线变化趋势是解本题关键,注意:反应体系中各物质的物质的量浓度相等时该反应不一定到达平衡状态,易错选项是C.


科目:高中化学 来源: 题型:选择题

| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) | |
| C. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| D. | 相同温度下,起始时向容器中充入2.0 mol PCl3 和2.0mol Cl2,达到平衡时,PCl3 的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 3:2:1 | C. | 6:3:1 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要有化学键断裂的变化一定是化学变化 | |
| B. | 并不是所有化学反应的速率都与压强有关 | |
| C. | 可逆反应达到平衡后,正、逆反应速率相等但不为零 | |
| D. | 装有NO2和N2O4混合气的密闭烧瓶加热后,颜色变深,说明该化学平衡发生了移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ② | Mg产生气泡速率快于Fe,Cu无明显变化 | 金属性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应C(s)+CO2(g)═2CO(g)的△H>0,△S<0 | |
| B. | 反应H+(aq)+OH-(aq)═H2O(l)的△H<0,△S<0 | |
| C. | 反应NH3(g)+HCl(g)═NH4Cl(s) 在低温下能自发进行,则该反应△H>0 | |
| D. | 反应CaCO3(s)═CaO(s)+CO2(g) 室温下不能自发进行,则该反应△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2和D2互为同位素 | |
| B. | 金刚石、石墨和“足球稀”C60为同素异形体 | |
| C. | 碳链为 与 与 的烃为同系物 的烃为同系物 | |
| D. |  和 和 互为同分异构体 互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com