
 某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小.
某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小. ;
; ;
;分析 某铵态氮肥由W、X、Y、Z等4种短周期元素组成,该铵盐中一定含有N、H元素,且W的原子半径最小,则W为H元素.
Ⅰ.若Y、Z同主族,ZY2是形成酸雨的主要物质之一,则ZY2为SO2,Y为O、Z为S元素,故X为N元素:
(1)X、Y、Z分别为N、O、S元素,分别处于第二周期ⅤA族、第二周期ⅥA族、第三周期ⅥA族;
(2)①N2H4分子中N原子之间形成1对共用电子对,N原子与H原子之间形成1对共用电子对;
②NH5为NH4H,由铵根离子与氢负离子构成;
③发生反应:4NH3+3O2═2N2+6H2O,计算4mol氨气反应放出的热量,注明物质聚集状态与反应热,书写热化学方程式;
Ⅱ.若Z是形成化合物种类最多的元素,则Z为C元素:
(4)该氮肥为碳酸铵或碳酸氢铵;
(5)a点时两种物质恰好完全反应,则c(HR)=$\frac{0.02L×0.25mol/L}{0.025L}$=0.2 mol/L,而HR溶液的pH=3,则HR为弱酸,NaR为强碱弱酸盐,溶液呈碱性,结合电荷守恒可知:c(R-)+c(OH-)-c(H+)=c(Na+);
②0.2 mol/L HR溶液中c(H+)=1.0×10-3mol/L,溶液中c(R-)≈c(H+),c(HR)≈0.2mol/L,代入电离常数Ka=$\frac{c({H}^{+})•c({R}^{-})}{c(HR)}$计算.
解答 解:某铵态氮肥由W、X、Y、Z等4种短周期元素组成,该铵盐中一定含有N、H元素,且W的原子半径最小,则W为H元素.
Ⅰ.若Y、Z同主族,ZY2是形成酸雨的主要物质之一,则ZY2为SO2,Y为O、Z为S元素,故X为N元素;
(1)X、Y、Z分别为N、O、S元素,分别处于第二周期ⅤA族、第二周期ⅥA族、第三周期ⅥA族,在周期表位置为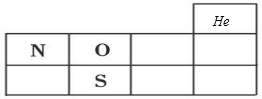 ,
,
故答案为: ;
;
(2)①N2H4分子中N原子之间形成1对共用电子对,N原子与H原子之间形成1对共用电子对,结构式为: ,故答案为:
,故答案为: ;
;
②NH5为NH4H,由铵根离子与氢负离子构成,电子式为 ,故答案为:
,故答案为: ;
;
③发生反应:4NH3+3O2═2N2+6H2O,4mol氨气反应放出的热量为382.8kJ×4=1531.2kJ,反应热化学方程式为:4NH3(g)+3O2(g)═2N2(g)+6H2O(l)△H=-1531.2 kJ•mol-1 ,
故答案为:4NH3(g)+3O2(g)═2N2(g)+6H2O(l)△H=-1531.2 kJ•mol-1 ;
Ⅱ.若Z是形成化合物种类最多的元素,则Z为C元素:
(4)该氮肥为碳酸铵或碳酸氢铵,故答案为:碳酸铵或碳酸氢铵;
(5)a点时两种物质恰好完全反应,则c(HR)=$\frac{0.02L×0.25mol/L}{0.025L}$=0.2 mol/L,而HR溶液的pH=3,则HR为弱酸,NaR为强碱弱酸盐,R-离子水解,溶液呈碱性,则pH>7,则c(Na+)>c(R-),水解程度微溶,溶液中离子浓度为:c(Na+)>c(R-)>c(OH-)>c(H+),结合电荷守恒可知:c(R-)+c(OH-)-c(H+)=c(Na+)=$\frac{0.02L×0.25mol/L}{0.045L}$≈0.11mol•L-1,故ab错误、c正确,
故答案为:>;c;
②0.2 mol/L HR溶液中c(H+)=1.0×10-3mol/L,溶液中c(R-)≈c(H+)=1.0×10-3mol/L,c(HR)≈0.2mol/L,电离常数Ka=$\frac{c({H}^{+})•c({R}^{-})}{c(HR)}$=$\frac{1×1{0}^{-3}×1×1{0}^{-3}}{0.2}$=5.0×10-6,
故答案为:5.0×10-6.
点评 本题属于拼合型题目,涉及元素推断、电子式、结构式、热化学方程式、盐类水解、电离平衡常数等,试题知识点较多、综合性较强,侧重考查考生对基本概念和基本原理的理解和应用能力,难度中等.


科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL | 0 | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可逆反应达到化学平衡状态时,正、逆反应速率均等于零 | |
| B. | 当反应物与生成物浓度相等时,可逆反应一定已达到化学平衡状态 | |
| C. | 用锌粉代替锌粒与等浓度的稀硫酸反应,生成氢气的速率加快 | |
| D. | Fe与稀硫酸反应制取氢气时,改用浓硫酸可以增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
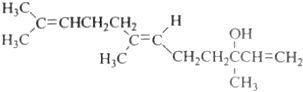
| A. | 橙花醇的分子式C15H26O | |
| B. | 橙花醇在浓硫酸催化下加热脱水,可以生成不止一种四烯烃 | |
| C. | 橙花醇既能发生取代反应,也能发生加成反应和氧化反应 | |
| D. | 1mol 橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240g溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将①与②分别稀释相同倍数后溶液的pH:①>② | |
| B. | 若②与③混合后溶液呈中性,则在常温下Ka(CH3COOH)=Kb(NH3.NH3) | |
| C. | ③与④中已电离的水分子的数目相等 | |
| D. | ②与④混合所得溶液显酸性,则:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) | |
| C. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| D. | 相同温度下,起始时向容器中充入2.0 mol PCl3 和2.0mol Cl2,达到平衡时,PCl3 的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA | |
| B. | 常温常压下,18.00克重水(D2O)中所含电子数约为10NA | |
| C. | 在熔融状态下1molNaHSO4所含阳离子数为2NA | |
| D. | 1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸的作用,脱水剂、强氧化剂 | B. | “黑面包”的主要成分:C | ||
| C. | 气体的主要成分:SO2、CO2 | D. | 白色沉淀只有CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要有化学键断裂的变化一定是化学变化 | |
| B. | 并不是所有化学反应的速率都与压强有关 | |
| C. | 可逆反应达到平衡后,正、逆反应速率相等但不为零 | |
| D. | 装有NO2和N2O4混合气的密闭烧瓶加热后,颜色变深,说明该化学平衡发生了移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com