
【题目】气体A的产量是衡量一个国家石油化工发展水平的标志,D是食醋中的主要成分。A能发生以下转化:

(1)A的结构简式为:__;①的反应类型是__;
(2)E是(写结构简式)__;
(3)写出相应转化过程的反应化学方程式。
②:__;③:__。
【答案】CH2=CH2 加成反应 ![]() 2CH3CH2OH+O2
2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3CH2OH+CH3COOH
2CH3CHO+2H2O CH3CH2OH+CH3COOH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
【解析】
气体A的产量是衡量一个国家石油化工发展水平的标志,则A是乙烯,乙烯和水发生加成反应生成乙醇,即B水乙醇,乙醇发生催化氧化生成乙醛,即C是乙醛。D是食醋中的主要成分,则D是乙酸,乙酸和乙醇发生酯化反应生成乙酸乙酯,即F是乙酸乙酯。乙烯含有碳碳双键,发生加聚反应生成聚乙烯,即E是聚乙烯,据此分析解答。
(1)根据分析,A为乙烯,其结构简式为CH2=CH2;①为乙烯和水发生加成反应生成乙醇,反应类型是加成反应;
(2)根据分析,E是聚乙烯,结构简式为![]() ;
;
(3)根据以上分析可知反应②是氧化反应,方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;反应③是酯化反应,方程式为CH3CH2OH+CH3COOH
2CH3CHO+2H2O;反应③是酯化反应,方程式为CH3CH2OH+CH3COOH![]() CH3COOC2H5+H2O。
CH3COOC2H5+H2O。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】格氏试剂RMgX由Mg和卤代烃RX在干燥下的乙醚中反应制得,广泛用于复杂有机物的合。下图是著名香料(![]() )的合成路线。
)的合成路线。

(1)写出反应Ⅰ的反应条件____,反应Ⅱ的反应类型为____,化合物C的名称是____。
(2)写出下列物质的结构简式: E____ , F____。
(3)写出苯 → C的化学方程式:____
(4)A有多种同分异构体,其中苯环上有两种化学环境氢的同分异构体(含-MgBr结构)有____种。
(5)设计原料(![]() )合成产物(
)合成产物( )的合成路线:____
)的合成路线:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和甲烷催化合成CO和H2是CO2资源化利用的有效途径。主要反应为
Ⅰ:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H=+247kJ/mol
2CO(g)+2H2(g) △H=+247kJ/mol
(1)已知CH4(g)+H2O(g) ![]() CO(g)+H2(g) △H=+206kJ/mol
CO(g)+H2(g) △H=+206kJ/mol
写出CH4和水蒸气反应生成CO2的热化学方程式_________。
(2)在恒温、恒容的密闭容器中发生反应I,下列选项能够说明反应I达到平衡状态的是______。
A.混合气体的密度不变
B.混合气体的总压强不变
C.CH4、CO2、CO、H2的物质的量之比为1:1:2:2
D.3V正(H2)=V逆(CH4)
E.混合气体的平均相对分子质量不变
(3)催化合成的温度通常维持在550-750℃之间,从反应速率角度分析其主要原因可能是_________。
(4)将CH4与CO2各1mol充入某密闭容器中,发生反应I。100Kpa时,反应I到达平衡时CO2的体积分数与温度的关系曲线如图所示。
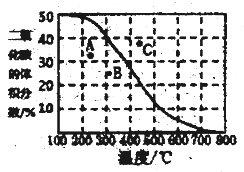
①图中A、B、C三点表示不同温度、压强下达到平衡时CO2的体积分数,则______点对应的平衡常数最小,判断依据是________;__________点对应的压强最大。
②300℃,100Kpa下,该容器中反应I经过40min达到平衡,计算反应在0-40min内的平均反应速率为v(CO2)=_________mol/min(结果保留两位有效数字),该温度下的压强平衡常数Kp=________。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2LSO3中含有原子数为2NA
B.用浓盐酸分别与MnO2、KClO3反应制备1molCl2,均转移电子2NA
C.将0.1molNH4NO3溶于适量的稀氨水,溶液恰好呈中性,溶液中NH4+数目小于0.1NA
D.2molNO和1molO2充分反应后,所得混合气体的分子数小于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸达到电离平衡后,改变某条件使电离平衡向正反应方向移动了,则下列说法正确的是![]()
A.醋酸的电离程度一定增大B.发生电离的分子总数增多
C.溶液的pH一定减小D.溶液的导电能力一定变强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是一种化工原料,可以制备一系列物质(见下图)。
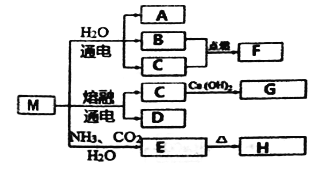
下列说法正确的是
A. 元素C、D形成的简单离子半径,前者大于后者
B. F的热稳定性比H2S弱
C. 化合物A、F中化学键的类型相同
D. 元素C、D的最高价氧化物的水化物均可以和H发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2 FeO4在水中不稳定,发生反应:![]() +l0H2O
+l0H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是 ( )
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是 ( )
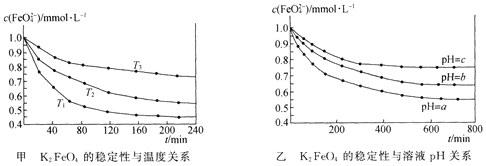
A.由图甲可知上述反应 △H < 0
B.由图甲可知温度:T1 > T2 > T3
C.由图甲可知K2 FeO4的稳定性随温度的升高而减弱
D.由图乙可知图中a < c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上在一定条件下将丙烷脱氢制丙烯.
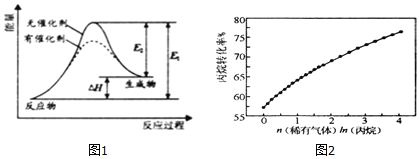
![]() 反应过程中能量变化如图1所示,下列有关叙述正确的是______.
反应过程中能量变化如图1所示,下列有关叙述正确的是______.
![]() 此反应为吸热反应
此反应为吸热反应
![]() 催化剂能改变反应的焓变和活化能
催化剂能改变反应的焓变和活化能
![]() 表示正反应的活化能,
表示正反应的活化能,![]() 表示逆反应的活化能
表示逆反应的活化能
![]() 有催化剂能加快反应速率,提高丙烷的转化率
有催化剂能加快反应速率,提高丙烷的转化率
![]() 上述反应在恒温恒容密闭容器中达到平衡,其平衡常数K的表达式为______
上述反应在恒温恒容密闭容器中达到平衡,其平衡常数K的表达式为______![]() 若升温,该反应的平衡常数______
若升温,该反应的平衡常数______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 若向上述反应达到平衡的容器内再通入少量丙烷,则
若向上述反应达到平衡的容器内再通入少量丙烷,则![]() ______
______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() .
.
![]() 在
在![]() 、800K条件下,向恒容密闭容器中通入丙烷和稀有气体,丙烷脱氢反应的转化率随着稀有气体与丙烷比例的变化情况如图2所示,则随着稀有气体与丙烷比例的增加,丙烷转化率逐渐增大的原因是______.
、800K条件下,向恒容密闭容器中通入丙烷和稀有气体,丙烷脱氢反应的转化率随着稀有气体与丙烷比例的变化情况如图2所示,则随着稀有气体与丙烷比例的增加,丙烷转化率逐渐增大的原因是______.
![]() 上述反应生成物丙烯经多步氧化生成丙酸,已知常温下
上述反应生成物丙烯经多步氧化生成丙酸,已知常温下![]() .
.
![]() 用离子方程式表示
用离子方程式表示![]() 溶液显碱性的原因______.
溶液显碱性的原因______.
![]() 常温下,若丙酸与氨水混合后溶液呈中性,则溶液中
常温下,若丙酸与氨水混合后溶液呈中性,则溶液中 ______.
______.
![]() 已知:
已知:
化学键 |
|
|
|
|
键能 | 436 | 413 | 348 | 612 |
则丙烷脱氢反应的热化学方程式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中加入4 mol A和2 mol B进行反应:3A(g)+2B(g) ![]() 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后的压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后的压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
A.该反应的化学平衡常数表达式是K=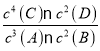
B.此时,B的平衡转化率是35%
C.增大该体系的压强,平衡正向移动,化学平衡常数增大
D.增加C,B的平衡转化率不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com