
����Ŀ����.������������11H����21H����31H����16O2����16O3���ش���������(�����)��
��1������5�����й�����___��Ԫ�أ�__��Ϊͬ�������壻
��2��___����Ϊͬλ�ء�
��.���������ṩ��һ�����ʻش����⣺
��HCl ��CaCl2 ��MgO ��Cl2 ��NaOH ��NH4Cl
��1���������ۼ�����___�����ӻ�������___��(����ű�ʾ)
��2���������Ӽ����й��ۼ�����___�����зǼ��Լ�����__��(����ű�ʾ)
��3��HCl�ĵ���ʽ��____��NaOH�ĵ���ʽ��____��MgO�ĵ���ʽ��____��
�õ���ʽ��ʾCaCl2���γɹ��̣�____________
�õ���ʽ��ʾCl2���γɹ��̣�______________
���𰸡�2 �ܢ� �٢ڢ� �٢� �ڢۢݢ� �ݢ� �� ![]()
![]()
![]()
![]()
![]()
��������
��.Ԫ���Ǿ�����ͬ�ĺ˵��������������ͬһ��ԭ�ӵ��ܳƣ���ͬһ��Ԫ���γɵIJ�ͬ���ʻ�Ϊͬ�������壬��������ͬ��������ͬ��ͬһ��Ԫ�صIJ�ͬ���ػ�Ϊͬλ�أ�
��. һ����õĽ����ͻ��õķǽ��������γ����Ӽ����ǽ���Ԫ�ص�ԭ�Ӽ������γɹ��ۼ����������Ӽ��Ļ����������ӻ����ȫ���ɹ��ۼ��γɵĻ������ǹ��ۻ�������ݻ�ѧ��������д����ʽ��
��.��1������5�����й�����2��Ԫ�أ�����Ԫ�غ���Ԫ�أ������ͳ���������Ԫ���γɵIJ�ͬ���ʣ�����Ϊͬ�������壻
��2��11H��21H��31H����������ͬ��������ͬ��������Ϊͬλ�ء�
��.��HCl��ֻ�м��Թ��ۼ������ڹ��ۻ����
��CaCl2��ֻ�����Ӽ����������ӻ����
��MgO��ֻ�����Ӽ����������ӻ����
��Cl2�к��зǼ��Թ��ۼ������ڵ��ʣ�
��NaOH�к������Ӽ����ۼ����������ӻ����
��NH4Cl�к������Ӽ����ۼ����������ӻ����
��1���������ۼ����Ǣ٢ܣ����ӻ������Тڢۢݢޣ�
��2���������Ӽ����й��ۼ����Ǣݢޣ����зǼ��Լ����Ǣܣ�
��3��HCl�ĵ���ʽΪ![]() ��NaOH�ĵ���ʽΪ
��NaOH�ĵ���ʽΪ![]() ��MgO�ĵ���ʽΪ
��MgO�ĵ���ʽΪ![]() ���õ���ʽ��ʾCaCl2���γɹ���Ϊ
���õ���ʽ��ʾCaCl2���γɹ���Ϊ![]() ���õ���ʽ��ʾCl2���γɹ���Ϊ
���õ���ʽ��ʾCl2���γɹ���Ϊ![]() ��
��


 ����ѧ����ϵ�д�
����ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(FeSO4��7H2O)��һ����Ҫ��ʳƷ���������Ӽ���ʵ����ͨ������ʵ���ɷ���м�Ʊ�FeSO4��7H2O���壺
�ٽ�5%Na2CO3��Һ���뵽ʢ��һ��������м���ձ��У����������ӣ�����������ȥNa2CO3��Һ��Ȼ����м��ˮϴ��2~3�飻
����ϴ�ӹ��ķ���м�м��������ϡ���ᣬ�����¶���50~80��֮������м�ľ���
�� ������Һת�뵽�ܱ������У����á���ȴ�ᾧ��
�ܴ��ᾧ��Ϻ��˳����壬��������ˮϴ��2~3�Σ�������ֽ���������ɣ�
�ݽ��Ƶõ�FeSO4��7H2O�������һ��С���ƿ�У��ܱձ��森
��ش��������⣺
��1��ʵ�鲽��ٵ�Ŀ����___________________________________________��
��2��д��ʵ�鲽����еĻ�ѧ����ʽ__________________________________________��
��3����ȫʵ�鲽��۵IJ�������_________________________��
��4��ʵ�鲽�������������ˮϴ�Ӿ��壬��Ŀ����_______________________________��
��5����ͬѧ��Ϊ��ʵ�鷽���д������ԵIJ�����֮������______(����������������)ͬ���ҵĹ۵�
��6����ͬѧ���������Ϻ��֣����������ڲ�ͬ�¶��½ᾧ�ɷֱ�õ�FeSO4��7H2O��FeSO4��4H2O��FeSO4��H2O�����������ڲ�ͬ�¶��µ��ܽ�Ⱥ��¶������������������±���ʾ(����56.7�桢64���¶��¿�ͬʱ�������־���)��
�����������ܽ�Ⱥ�������������
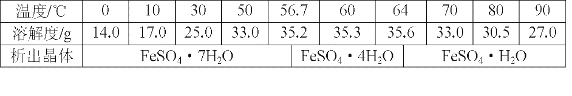
����ݱ������ݻ��������������ܽ������ʾ��ͼ��__
��7�����������������Һ�нᾧ��FeSO4��4H2O��Ӧ���ƵĽᾧ�¶�(t)�ķ�ΧΪ________________��
��8��ȡ���в����������̷�����(�������������ԭ��������M��ʾ)wg�����Ƴ�100 mL��c mol/L KMnO4����Һ�ζ����յ�ʱ���ı�Һ�����ΪVmL�������ڵζ��յ��ȡ�ζ��ܶ���ʱ�����ӵζ���Һ�棬ʹ�ⶨ���________(����ƫ��������ƫ����������Ӱ����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ҵ�����У����뷴Ӧ���Ļ��������NO��O2�����ʵ��������ֱ�Ϊ0.10��0.06��������ѧ��Ӧ2NO(g)+O2(g)=2NO2(g)��������������ͬʱ�����ʵ���������±���
ѹǿ/(��105Pa) | �¶�/�� | NO�ﵽ����ת������Ҫʱ��/s | ||
50% | 90% | 98% | ||
1.0 | 30 | 12 | 250 | 2830 |
90 | 25 | 510 | 5760 | |
8.0 | 30 | 0.2 | 3.9 | 36 |
90 | 0.6 | 7.9 | 74 | |
���ݱ������ݣ�����˵����ȷ����
A. �����¶ȣ���Ӧ���ʼӿ�
B. ����ѹǿ����Ӧ���ʱ���
C. ��1.0��105Pa��90�������£���ת����Ϊ98%ʱ�ķ�Ӧ�Ѵﵽƽ��
D. �����뷴Ӧ���Ļ������Ϊamol����Ӧ������v=��n/��t��ʾ������8.0��105Pa��30��������ת���ʴ�50%����90%ʱ��NO�ķ�Ӧ����Ϊ4a/370mol/s
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������A�ǽ��������õĹ�¯ˮ���Ӽ�����ṹʽ��ͼ��A�ܳ�ȥ��¯ˮ���ܽ������������˵����ȷ���ǣ� ��
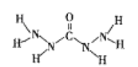
A. A����������ԭ�Ӷ���ͬһƽ����
B. A��������������������������֮��Ϊ10��1
C. ����C��N��Ϊsp2�ӻ�
D. A��O2��Ӧ����CO2��N2��H2O�����ʵ���֮��Ϊ1��2��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԻ�ѧ��Ӧ����ʶ��ȷ���ǣ�������
A.��ѧ��Ӧ�����У��ϼ����ȣ��ɼ�����
B.���ij��ѧ��Ӧ�ġ�H�͡�S��С��0����Ӧһ�����Է�����
C.����ͬһ����ѧ��Ӧ��һ����ɺͷּ�����ɣ��䷴Ӧ���ʱ䲻��ͬ
D.��Ӧ������ʴ��ڷ�Ӧ���������ʱ����H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�������ͨ����Ӧ����ֱ�ӻ��϶��ɵ��ǣ� ��
A.FeCl2B.CuSC.Na2O2D.SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����60 g�����46 g�Ҵ���Ӧ�����ʵ�ʲ��������۲��ʵ�һ�룬��ɵõ�������������������( )
A. 29.5gB. 44 gC. 74.8 gD. 88 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ɳ�������ִ��������й㷺Ӧ�ã����ij䡢�ŵ練Ӧ����ʽ���У�Cd+2NiOOH+2H2O![]() Cd��OH��2+2Ni��OH��2 ���ɴ��ж��������ǣ��� ��
Cd��OH��2+2Ni��OH��2 ���ɴ��ж��������ǣ��� ��
A���ŵ�ʱ��Cd������
B���ŵ�ʱ��NiO(OH)������
C���������ҺΪ������Һ
D���ŵ�ʱ��������ӦΪCd+2OH-��2e-=Cd(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ������Ϊx��Ԫ��E�����ڱ���λ��A��B��C��D����Ԫ���м�(��ͼ��ʾ)����A��B��C��D����Ԫ�ص�ԭ������֮�Ͳ�������(��ϵ���ϵ��0��Ԫ�س���)(����)
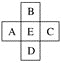
A. 4xB. 4x��14
C. 4x��10D. 4x��6
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com