
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
![]() 五种元素原子半径由大到小的顺序是
五种元素原子半径由大到小的顺序是![]() 写元素符号
写元素符号![]() ______。
______。
![]() 与Z能形成多种化合物,请写出其中既含极性键又含非极性键的物质的分子式______。
与Z能形成多种化合物,请写出其中既含极性键又含非极性键的物质的分子式______。
![]() 由以上某些元素组成的化合物A、B、C、D有如下转化关系:
由以上某些元素组成的化合物A、B、C、D有如下转化关系:![]() 其中,A、B、D均由三种元素组成,B为两性不溶物,C是一种能造成温室效应的气体。则C的结构式为______;D的电子式______;由A与足量C反应转化为B的离子方程式为______;向D溶液中逐渐通入一定量的气体C,随后向溶液中逐渐加入的
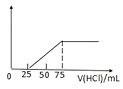
其中,A、B、D均由三种元素组成,B为两性不溶物,C是一种能造成温室效应的气体。则C的结构式为______;D的电子式______;由A与足量C反应转化为B的离子方程式为______;向D溶液中逐渐通入一定量的气体C,随后向溶液中逐渐加入的![]() 盐酸,产生的气体体积与所加入的盐酸的体积之间的关系如图所示,则溶液中通入气体后,所得的溶液中的溶质为______,产生的气体体积
盐酸,产生的气体体积与所加入的盐酸的体积之间的关系如图所示,则溶液中通入气体后,所得的溶液中的溶质为______,产生的气体体积![]() 标准状况
标准状况![]() 为______L。
为______L。
【答案】![]()
![]()
![]()
![]()
![]()
![]() 、
、![]()
![]()
【解析】
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0,则X、Y可以为H、C、Si;但是Q与X同主族,则X为H;Y为C;Q为Na;Z、R分别是地壳中含量最高的非金属元素和金属元素,则Z、R分别为O、Al。
![]() 同周期自左而右原子半径减小,同主族自上而下原子半径增大,所有元素中氢原子半径最小,故这几种元素原子半径大小顺序是:
同周期自左而右原子半径减小,同主族自上而下原子半径增大,所有元素中氢原子半径最小,故这几种元素原子半径大小顺序是:![]() ,
,
故答案为:![]() ;
;
![]() 氢
氢![]() 与
与![]() 氧
氧![]() 形成的既含极性键又含非极性键物质为
形成的既含极性键又含非极性键物质为![]() ,故答案为:
,故答案为:![]() ;
;
![]() 由以上某些元素组成的化合物A、B、C、D有如下转化关系:
由以上某些元素组成的化合物A、B、C、D有如下转化关系:![]() ,C是一种能造成温室效应的气体,则C是
,C是一种能造成温室效应的气体,则C是![]() ,A、B、D均由三种元素组成,B为两性不溶物,则B是
,A、B、D均由三种元素组成,B为两性不溶物,则B是![]() ,A为
,A为![]() ,D
,D
C的结构式为:![]() ,D的电子式为
,D的电子式为![]() ;由A与足量C反应转化为B的离子方程式为:
;由A与足量C反应转化为B的离子方程式为:![]() ,
,
假设二氧化碳与NaOH反应后溶液中只有![]() ,开始发生反应:
,开始发生反应:![]() ,而后发生反应:
,而后发生反应:![]() ,前后两阶段消耗盐酸的体积相等,而实际前、后两阶段消耗盐酸体积分别为25mL、50mL,前阶段消耗盐酸体积小于后阶段,溶液中通入气体后,所得的溶液中的溶质是
,前后两阶段消耗盐酸的体积相等,而实际前、后两阶段消耗盐酸体积分别为25mL、50mL,前阶段消耗盐酸体积小于后阶段,溶液中通入气体后,所得的溶液中的溶质是![]() 、
、![]() ,生成二氧化碳阶段消耗盐酸条件为50mL,根据
,生成二氧化碳阶段消耗盐酸条件为50mL,根据![]() ,可知
,可知![]() ,故标况下:
,故标况下:![]() ,
,
故答案为:![]() ;
;![]() ;
;![]() ;
;![]() 、
、![]() ;
;![]() 。
。


科目:高中化学 来源: 题型:
【题目】用20g烧碱配制成500mL溶液。
(1)所得溶液的物质的量浓度为多少?(写出计算过程,下同)
(2)从中取出lmL,将其用水稀释到l00mL,所得溶液中溶质的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(原创)如图表示不同温度下水溶液中c(H+)与c(OH-)的关系,下列判断正确的是( )
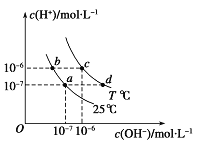
A.两条曲线上任意点均有c (H+) ×c (OH-)=Kw
B.T<25℃
C.b点和c点pH均为6,溶液呈酸性
D.只采用升温的方式,可由a点变成d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是_____。(用元素符号回答)
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:
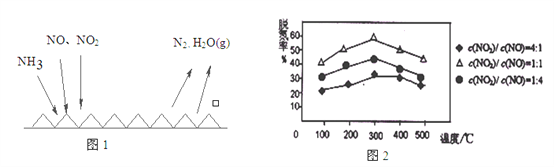
①由图1可知SCR技术中的氧化剂为:_________________。
②用Fe做催化剂时,在氨气足量的情况下,不同c(NO)/c(NO2)对应的脱氮率如图2所示,效果最佳的c(NO)/ c(NO2)=_________。
(3)硝酸厂常用如下烧碱吸收法处理氦氧化物(NO与NO2)尾气。氮氧化物(NO与NO2)用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收。已知反应后溶液中含有0.35mo1NaNO2。则尾气中NO与NO2的物质的量之比为______。(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O、NO+NO2+2NaOH=2NaNO2+H2O)
(4)现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸[假设反应中稀硝酸的还原产物只有NO),产生气体在标准状况下的体积与剩余固体的质量如下表:
硝酸体枳(mL) | 100 | 200 | 300 | 400 |
剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
放出气体的体积(mL) | 2240 | 4480 | 6720 |
计算原混合物中铁和铜的物质的量比为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
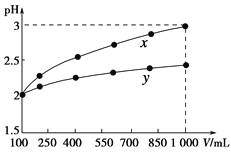
A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的HCN气体,同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25°C) | Ka=l. 77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5. 6×10-11 |
下列选项错误的是
A.向NaCN溶液中通入少量的CO2发生的离子反应为:2CN-+H2O+CO2= 2HCN+CO32-
B.室温下,处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN)
C.中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者
D.等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个1L的密闭容器中,加入2molA和1molB进行如下反应:2A(g)+2B(g)![]() 3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数K约为0.043
B. 增加C的物质的量,B的平衡转化率不变
C. 增大该体系的压强,平衡正向移动,化学平衡常数增大
D. A的平衡转化率是40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度和压强下,对反应CO2(g)+H2(g)![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
| CO2 | H2 | CO | H2O |
甲 | amol | amol | 0mol | 0mol |
乙 | 2amol | amol | 0mol | 0mol |
丙 | 0mol | 0mol | amol | amol |
丁 | amol | 0mol | amol | amol |
上述四种情况达到平衡后,n(CO)的大小顺序是
A. 乙=丁>丙=甲B. 乙>丁>甲>丙
C. 丁>乙>丙=甲D. 丁>丙>乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法不正确的是
A. 向![]() 溶液中通入
溶液中通入![]() ,
,![]() 减小
减小
B. 将![]() 的
的![]() 溶液从
溶液从![]() 升温至
升温至![]() ,
,![]() 增大
增大
C. 向![]() 的HF溶液中滴加NaOH溶液至中性,
的HF溶液中滴加NaOH溶液至中性,![]() =1
=1
D. 向![]() 的
的![]() 溶液中加入少量水,
溶液中加入少量水,![]() 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com