
【题目】有机物A可用作有机合成、食品、化妆品、医药的杀菌防腐剂。由A可合成香精H,其转化关系如下:

已知以下信息:
①A、D、H均能与FeCl3溶液发生显色反应;
②1molC与足量新制Cu(OH)2共热,可生成2molCu2O;
③核磁共振氢谱显示:D分子中有4种不同化学环境的氢原子;
④G的相对分子质量比E大16。
回答下列问题:
(1)A中含氧官能团的名称是___________。
(2)B的结构简式为___________。
(3)反应D+G→H的化学方程式为____________________,该反应的反应类型为___________。
(4)E能被酸性KMnO4溶液直接氧化为K,K能与NaHCO3发生反应。K的同分异构体中含有苯环的有____种(不包括K自身),其中既能发生银镜反应,又能发生水解反应的是______(填结构简式)。
(5)参照H的上述合成路线,设计一条以A和![]() 为原料(其他无机试剂任选)制备
为原料(其他无机试剂任选)制备 的合成路线:__________________________________。
的合成路线:__________________________________。
【答案】 酯基、羟基 CH3OH 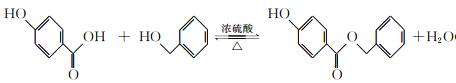 酯化反应(或取代反应) 4
酯化反应(或取代反应) 4 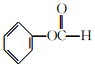
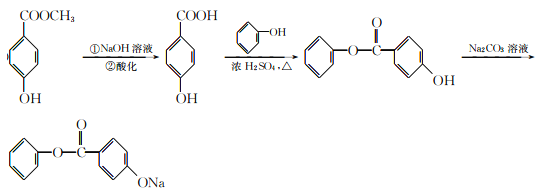
【解析】根据有机物E连续变化为G,可知G中含有7个碳,有机物H共有14个碳,所以有机物D含有7个碳,有机物A共有8个碳,所以B中有一个碳,它能发生氧化反应生成C,1molC与足量新制Cu(OH)2共热,可生成2molCu2O;说明C中有两个醛基,该有机物只能为甲醛;B为甲醇;A、D、H均能与FeCl3溶液发生显色反应,说明有机物中均含有酚羟基,有机物A水解得到甲醇和D,核磁共振氢谱显示D分子中有4种不同化学环境的氢原子;所以D结构简式为对羟基苯甲酸,G为苯甲醇;有机物A为对羟基苯甲酸甲酯;
(1)A为对羟基苯甲酸甲酯,所含有的含氧官能团的名称是酯基、羟基;正确答案:酯基、羟基。
(2)B为甲醇,结构简式为CH3OH;正确答案:CH3OH。
(3)有机物D为对羟基苯甲酸,有机物G为苯甲醇,二者发生取代反应生成酯和水,反应化学方程式: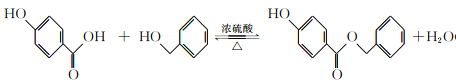 ;
;
正确答案: ,酯化反应(或取代反应)。
,酯化反应(或取代反应)。
(4)有机物E为甲苯,能被酸性KMnO4溶液直接氧化为苯甲酸(有机物K),苯甲酸
能与NaHCO3发生反应;把-COOH变为HCOO-基团,有1种,把-COOH变为-CHO 和–OH两种基团,环上的位置有3种,该有机物的同分异构体共有4种;其中既能发生银镜反应,又能发生水解反应的有机物结构中含有HCOO-基团,结构简式为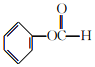 ;正确答案:4 ;
;正确答案:4 ;  。
。
(5)A为对羟基苯甲酸甲酯,在碱性条件下发生水解生成钠盐,再进行酸化,得到对羟基苯甲酸,根据生成物看出,该物质为酚酯,所以对羟基苯甲酸与苯酚在一定条件下发生酯化反应,生成了酯;根据酯在碳酸钠溶液中溶解度最小,且不发生反应,而苯环上酚羟基能够与碳酸钠反应生成酚钠,最终得到了所需要的产物;合成路线如下:
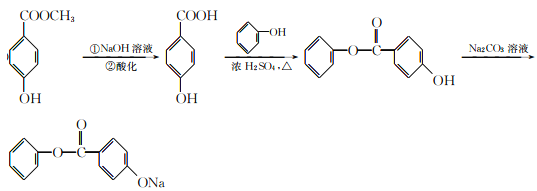
正确答案:



 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】中学化学常见物质甲、乙、丙、丁之间存在如下转化关系:甲 + 乙 → 丙 + 丁。下列说法正确的是( )
A. 若甲为铜,丁为氯化亚铁,则乙一定是氯化铁
B. 若甲为碳,丁为硅,则丙一定是二氧化碳
C. 若甲为铝,丁为铁,则乙一定是氧化铁
D. 若甲为镁,丁为氢气,则乙一定是酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各組离子在指定溶液中能大量共存的是
A. 澄清透明的溶液中: Fe3+、Mg2+、SCN-、Cl-、
B. c(H+)/c(OH-)=1×10-12的溶液中:K+、Na+、CO32-、NO3-
C. c(Fe3+) =lmol/L的溶液中:Na+、NH4+、A1O2-、SO42-
D. 能使甲基橙变紅的溶液中: K+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以化合物A为原料合成化合物M的线路如下图所示。

(1)写出化合物B中含氧官能团的名称为________________。
(2)①的反应类型为________________。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式_____________。
①能与FeCl3发生显色反应;②分子中有3种不同化学环境的氢;
(4)E与Y反应生成M同时还生成甲醇,写出Y(C5H8O4)的结构简式________。
(5)以苯酚、乙醇、![]() 为有机原料合成
为有机原料合成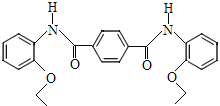 ,写出制备的合成路线流程图_____________ (无机试剂任用,合成路线流程图示例见本题题干)。
,写出制备的合成路线流程图_____________ (无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室回收利用废旧锂离子电池正极材料锰酸锂(LiMn2O4)的一种流程如下:
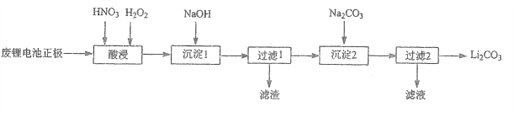
(1)废旧电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是____________。
(2)“酸浸”时采用HNO3和H2O2的混合液体,可将难溶的LiMn2O4转化为Mn(NO3)2、LiNO3等产物。请写出该反应离子方程式___________________。
如果采用盐酸溶解,从反应产物的角度分析,以盐酸代替HNO3和H2O2混合物的缺点是____________。
(3)“过滤2”时,洗涤Li2CO3沉淀的操作是_______________________。
(4)把分析纯碳酸锂与二氧化锰两种粉末,按物质的量1:4混合均匀加热可重新生成LMn2O4,升温到515℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723℃)低很多,可能的原因是__________。
(5)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7。请补充由上述过程中,制得的Mn(OH)2制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2SO4、Na2CO3、C2H5OH];向Mn(OH)2中边搅拌边加入_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一套检验气体性质的实验装置。向装置中缓慢地通入气体X,若关闭活塞K,则品红试液无变化,而澄清石灰水变浑浊;若打开活塞 K,则品红试液褪色。据此判断气体X和洗气瓶内液体Y可能是
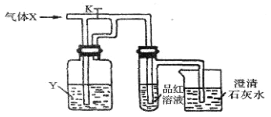
A | B | C | D | |
X | H2S | SO2 | CO2 | Cl2 |
Y | 浓硫酸 | NaHCO3饱和溶液 | Na2SO3溶液 | NaHSO3饱和溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. CH3Cl(g)+Cl2(g) ![]() CH2Cl2(1)+HCl(g)能自发进行, 则该反应的ΔH>0
CH2Cl2(1)+HCl(g)能自发进行, 则该反应的ΔH>0
B. 向氨水中不断通入CO2,随着CO2的增加, ![]() 不断减小
不断减小
C. 常温下,pH为5的氯化铵溶液和pH为5的醋酸溶液中水的电离程度相同
D. 探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO和O2转化为NO2的反应机理如下:
①2NO(g)![]() N2O2(g)(快) △H1<0平衡常数K1
N2O2(g)(快) △H1<0平衡常数K1
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) △H2<0平衡常数K2
2NO2(g)(慢) △H2<0平衡常数K2

下列说法正确的是( )
A. 2NO(g)+O2(g)![]() 2NO2(g)的△H=-(△H1+△H2)
2NO2(g)的△H=-(△H1+△H2)
B. 2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K= K1/K2
2NO2(g)的平衡常数K= K1/K2
C. 反应②的速率大小决定2NO(g)+O2(g)![]() 2NO2(g)的反应速率
2NO2(g)的反应速率
D. 反应过程中的能量变化可用图a表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
B.Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
C.Na2O是淡黄色固体,Na2O2是白色固体
D.Na2O2和Na2O焰色反应均为黄色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com