
| A、主族元素的电负性越大,元素原子的第一电离能一定越大 |
| B、在元素周期表中,元素电负性从左到右越来越小 |
| C、金属元素的电负性一定小于非金属元素的电负性 |
| D、在形成化合物时,电负性越小的元素越容易显正价 |


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
| c(CH3COO-) |
| c(H+) |
| c(CH3COO-) |
| c(CH3COOH)?c(OH-) |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 前四周期元素A、B、C、D、E原子序数依次增大,A是周期表所有原子中原子半径最小的,B有三个能级,且各个能级上电子数相等,D与C同周期,且C中未成对电子是该周期中最多的;D基态原子的2p电子是2s电子的2倍;E有4个电子层,且与A最外层电子数相同,其他各层均排满.
前四周期元素A、B、C、D、E原子序数依次增大,A是周期表所有原子中原子半径最小的,B有三个能级,且各个能级上电子数相等,D与C同周期,且C中未成对电子是该周期中最多的;D基态原子的2p电子是2s电子的2倍;E有4个电子层,且与A最外层电子数相同,其他各层均排满.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 小苏打作为食品制作过程中的膨松剂在食品加工产业上有广泛的用途.
小苏打作为食品制作过程中的膨松剂在食品加工产业上有广泛的用途.| 物理量 | 样品质量/g | … | ||
| 实 验 | a | … |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
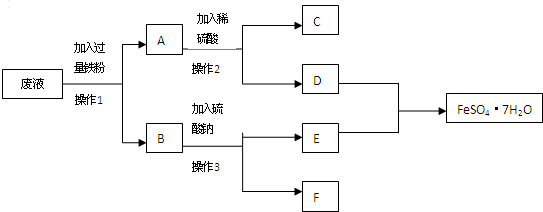
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com