
 前四周期元素A、B、C、D、E原子序数依次增大,A是周期表所有原子中原子半径最小的,B有三个能级,且各个能级上电子数相等,D与C同周期,且C中未成对电子是该周期中最多的;D基态原子的2p电子是2s电子的2倍;E有4个电子层,且与A最外层电子数相同,其他各层均排满.
前四周期元素A、B、C、D、E原子序数依次增大,A是周期表所有原子中原子半径最小的,B有三个能级,且各个能级上电子数相等,D与C同周期,且C中未成对电子是该周期中最多的;D基态原子的2p电子是2s电子的2倍;E有4个电子层,且与A最外层电子数相同,其他各层均排满.| 5+2+1 |
| 2 |
| 5+1 |
| 2 |


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
| A、10g质量分数为46%的乙醇溶液中,氢原子的总数为1.2NA |
| B、5.6 g铁与足量硫加热充分反应转移电子数为 0.2NA |
| C、50 mL 12 mol?L-1 浓盐酸与足量二氧化锰加热反应,转移电子数为0.3 NA |
| D、标准状况下,含有1mol硫原子的SO2与SO3的混合物,其体积小于22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
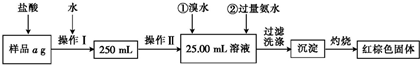
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 10℃ | 20℃ | 30℃ |
| 溶解度(g/100g H2O) | 2.5 | 3.9 | 5.6 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | ①若出现 |
| 步骤3:取适量步骤1中的沉淀于试管中,滴加盐酸,连接带塞导气管将产生的气体导入澄清石灰水. | ②若出现 |
| 步骤4:取步骤1中的滤液于烧杯中,用pH计测定其pH. | ③若pH_ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相 关 信 息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | Y元素的激发态原子的电子排布式为1s22s22p63s23p34s1 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、主族元素的电负性越大,元素原子的第一电离能一定越大 |
| B、在元素周期表中,元素电负性从左到右越来越小 |
| C、金属元素的电负性一定小于非金属元素的电负性 |
| D、在形成化合物时,电负性越小的元素越容易显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2SO3已部分被氧化 |
| B、加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 |
| C、加硝酸后的不溶沉淀一定是BaSO4和BaSO3 |
| D、此实验不能确定Na2SO3是否部分被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、⑤ | B、①②⑤ | C、③④ | D、③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com