
| 2 |
| 3 |
| 5-3×1 |
| 2 |
| 2 |
| 3 |


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
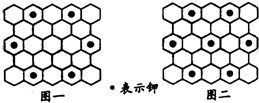 北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的石墨夹层离子化合物.将石墨置于熔融的钾或气态的钾中,石墨吸收钾而形成称为钾石墨的物质,其组成可以是C8K、C12K、C24K、C36K、C48K、C60K等等.在钾石墨中,钾原子把价电子交给石墨层,但在遇到与金属钾易反应的其他物质时还会收回.下列分析中正确的是( )
北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的石墨夹层离子化合物.将石墨置于熔融的钾或气态的钾中,石墨吸收钾而形成称为钾石墨的物质,其组成可以是C8K、C12K、C24K、C36K、C48K、C60K等等.在钾石墨中,钾原子把价电子交给石墨层,但在遇到与金属钾易反应的其他物质时还会收回.下列分析中正确的是( )| A、题干中所举出的6种钾石墨,属于同素异形体 | ||
| B、若某钾石墨的原于分布如图一所示,则它所表示的是C24K | ||
| C、若某钾石墨的原子分布如图二所示,则它所表示的是C12K | ||
D、另有一种灰色的钾石墨C32K,其中K的分布也类似图中的中心六边形,则最近两个K原子之间的距离为石墨键长的4
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 10℃ | 20℃ | 30℃ |
| 溶解度(g/100g H2O) | 2.5 | 3.9 | 5.6 |
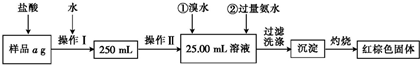
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | ①若出现 |
| 步骤3:取适量步骤1中的沉淀于试管中,滴加盐酸,连接带塞导气管将产生的气体导入澄清石灰水. | ②若出现 |
| 步骤4:取步骤1中的滤液于烧杯中,用pH计测定其pH. | ③若pH_ |
查看答案和解析>>
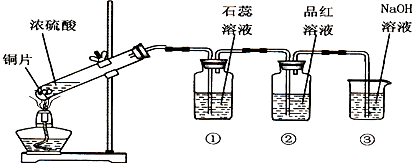
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、主族元素的电负性越大,元素原子的第一电离能一定越大 |
| B、在元素周期表中,元素电负性从左到右越来越小 |
| C、金属元素的电负性一定小于非金属元素的电负性 |
| D、在形成化合物时,电负性越小的元素越容易显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ? | ? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com