
【题目】工业上或实验室提纯以下物质的方法不合理的是(括号内为杂质)( )
A.溴苯(溴):加NaOH溶液,分液
B.乙烷(乙烯):通入溴水,洗气
C.乙酸(水):加新制生石灰,蒸馏
D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,分液
科目:高中化学 来源: 题型:
【题目】偶氮苯是橙红色晶体,溶于乙醇,微溶于水,实验室制取反式偶氮苯的步骤如下:
步骤一:在反应器中加入一定量的硝基苯、甲醇和一小粒碘,装上冷凝管,加入少量镁粉,立即发生反应。等大部分镁粉反应完全后,再加入镁粉,反应继续进行,等镁粉完全反应后,加热回流30 min。
步骤二:将所得液体趁热倒入冰水中,并不断搅拌,用冰醋酸小心中和至pH 为4~5,析出橙红色固体,过滤,用少量冰水洗涤。
步骤三:用95%的乙醇重结晶。
(1)步骤一中反应不需要加热就能剧烈进行,原因是____________。镁粉分两次加入的原因是______________。
(2)步骤二中析出固体用冰水洗涤的原因是______________。若要回收甲醇,实验所需的玻璃仪器除冷凝管、酒精灯、牛角管和锥形瓶外还应有___________。
(3)取0.1g偶氦苯,溶于5 mL左右的苯中,将溶液分成两等份,分别装于两个试管中,其中一个试管用黑纸包好放在阴暗处,另一个则放在阳光下照射。用毛细管各取上述两试管中的溶液点在距离滤纸条末端1cm处,再将滤纸条末端浸入裝有1: 3 的苯-环己烷溶液的容器中,实验操作及现象如图所示。
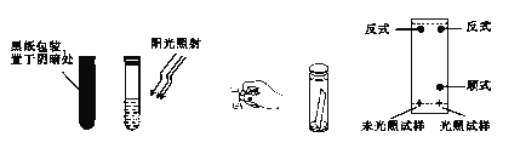
①实验中分离物质所采用的方法是_______法。
②由实验结果可知:_______;利用该方法可以提纯反式偶氮苯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砹是原子序数最大的卤族元素,根据卤素性质的递变规律,对砹及其化合物的叙述,正确的是( )
A. 与H2的化合能力:At2>I2
B. 砹在常温下为白色固体
C. 砹原子的最外电子层上有7个电子
D. 砹易溶于水,难溶于四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题目要求填空:
(1)硫、氮的氧化物是主要的大气污染物,对大气的影响之一是导致酸雨.用化学方程式表示NO2形成酸雨的原因: , 该反应中氧化剂和还原剂的物质的量之比为 .
(2)实验室常用的几种气体发生装置如图1A、B、C所示: 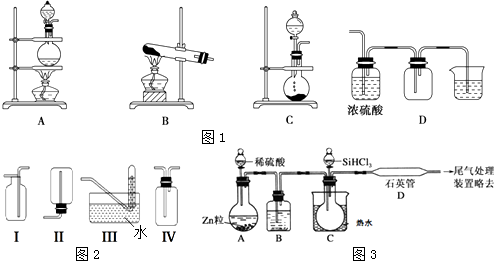
实验室可以用B或C装置制取氨气,如果用B装置,反应的化学方程式是;如果用C装置,通常使用的药品是(写名称);图2是某学生设计收集氨气的几种装置,其中可行的是 . 若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的
A.CO2 B.NO C.Cl2 D.H2
写出A装置中反应的离子方程式 .
(3)氢化钠(NaH)是一种还原性极强的物质,广泛应用于工业生产.
氢化钠(NaH)中Na元素的化合价为+1,在高温下氢化钠(NaH)可将四氯化钛(TiCl4)还原成金属钛,该反应的化学方程式为 .
NaH能与水剧烈反应:NaH+H2O═NaOH+H2↑,NaH与液氨(NH3)也有类似反应,该反应的化学方程式为 . 如果有12g NaH参加此反应,则转移电子的物质的量为mol
(4)用SiHCl3与过量H2反应制备纯硅的装置如图3所示(热源及夹持装置均已略去):
SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:;H2还原SiHCl3过程中若混入O2 , 可能引起的后果是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( O-16 )
A. 1 mol CO2的质量为44 g/mol B. H2SO4的摩尔质量为98
C. 标准状况下,气体摩尔体积为22.4 L D. O2的相对分子质量为32
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时将浓度均为0.1mol·L-1、体积分别为Va和Vb的HA 溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示,下列说法正确的是
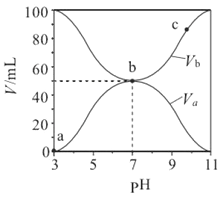
A. a→c 过程中水的电离程度始终增大
B. b点时,c(B+)=c(A-)=c(H+)=c(OH-)
C. c点时, 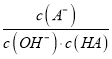 随温度升高而减小
随温度升高而减小
D. 相同温度下,Ka(HA)>Kb(BOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质与条件已略去)。A是最常见的无色液体,B、C是常见的金属单质,D、E是气体单质,且D在空气中的含量最多,F是一种具有磁性的化合物,H是既能与强酸反应又能与强碱反应的氧化物;I具有耐高温、抗冲击、导热性好的优良性质,广泛应用于电子工业、陶瓷工业中。

请回答下列问题:
(1) H的化学式为________________。
(2) D的电子式为________________。
(3) 写出反应①的化学方程式:________________。
(4) 写出G的水溶液与C的硝酸盐溶液反应的离子方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物广泛应用于高新材料领域,请回答下列有关问题:
(1)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图)。
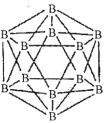
①在基态11B原子中,核外存在______对自旋相反的电子。
②若每个单元中有两个原子为l0B,其余为11B,则该单元结构的类型有______种。
(2)NaBH4是一种重要的储氢载体,其中涉及元素的电负性由小到大的顺序为________,BH4-离子的空间构型是_____________,与BH4-互为等电子体的的分子有___________。
(3)硼酸(H3BO3)为白色片状晶体,有与石墨相似的层状结构,则硼酸晶体中存在的作用力有共价键、_____、_______。与H3BO3酸性最接近的是__________(填字母)。
A.H4SiO4 B.H3PO4 C.HNO2
(4)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。如图是磷化硼晶体的晶胞,B原子的杂化方式是___________。立方相氮化硼晶体的熔点要比磷化硼体高,其原因是_____________。
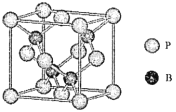
(5)己知磷化硼的晶胞参数a=478 pm,请列式计算该晶体的密度p=_____g.cm-3(用含NA的代数式表示即可,不需要计算出结果)。晶胞中硼原子和磷原子最近的核间距为_________pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com