
【题目】根据题目要求填空:
(1)硫、氮的氧化物是主要的大气污染物,对大气的影响之一是导致酸雨.用化学方程式表示NO2形成酸雨的原因: , 该反应中氧化剂和还原剂的物质的量之比为 .
(2)实验室常用的几种气体发生装置如图1A、B、C所示: 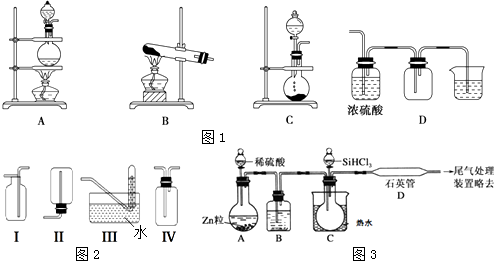
实验室可以用B或C装置制取氨气,如果用B装置,反应的化学方程式是;如果用C装置,通常使用的药品是(写名称);图2是某学生设计收集氨气的几种装置,其中可行的是 . 若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的
A.CO2 B.NO C.Cl2 D.H2
写出A装置中反应的离子方程式 .
(3)氢化钠(NaH)是一种还原性极强的物质,广泛应用于工业生产.
氢化钠(NaH)中Na元素的化合价为+1,在高温下氢化钠(NaH)可将四氯化钛(TiCl4)还原成金属钛,该反应的化学方程式为 .
NaH能与水剧烈反应:NaH+H2O═NaOH+H2↑,NaH与液氨(NH3)也有类似反应,该反应的化学方程式为 . 如果有12g NaH参加此反应,则转移电子的物质的量为mol
(4)用SiHCl3与过量H2反应制备纯硅的装置如图3所示(热源及夹持装置均已略去):
SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:;H2还原SiHCl3过程中若混入O2 , 可能引起的后果是 .
【答案】
(1)3NO2+H2O=2HNO3+NO;1:2
(2)2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;浓氨水和氧化钙(或碱石灰、固体氢氧化钠等);C;Ⅳ;MnO2+4H++2Cl﹣═Mn2++Cl2↑+2H
CaCl2+2NH3↑+2H2O;浓氨水和氧化钙(或碱石灰、固体氢氧化钠等);C;Ⅳ;MnO2+4H++2Cl﹣═Mn2++Cl2↑+2H
(3)TiCl4+4NaH ![]() 4NaCl+Ti+2H2↑;?NaH+NH3═NaNH2+H2↑;0.5
4NaCl+Ti+2H2↑;?NaH+NH3═NaNH2+H2↑;0.5
(4)SiHCl3+3H2O═H2SiO3↓+3HCl+H2↑;高温下H2与O2混合发生爆炸
【解析】解:(1)二氧化氮与水发生反应:3NO2 +H2O=2HNO3 +NO,有硝酸生成,导致形成酸雨,根据N元素化合价变化,可知其氧化剂的NO2生成NO,起还原剂的NO2生成HNO3 , 由方程式可知,该反应中氧化剂和还原剂的物质的量之比为1:2,所以答案是:3NO2 +H2O=2HNO3 +NO;1:2;(2)采用B装置制备氨气时应选择用氢氧化钙和氯化铵固体加热反应,反应方程式:Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O;C装置适用于固体和液体不加热制气体,制取氨气应选择浓氨水和氧化钙或碱石灰或氢氧化钠固体;氨气密度小于空气密度,极易溶于水,应选择向下排气法收集,不能用排水法收集,收集不能用密封装置,所以只有Ⅳ符合题意;若用A装置与D装置相连制取收集X气体,制取气体的特点为:反应物为固体与液体加热,密度大于空气密度,且气体可利用浓硫酸干燥,需要尾气处理;
CaCl2+2NH3↑+2H2O;C装置适用于固体和液体不加热制气体,制取氨气应选择浓氨水和氧化钙或碱石灰或氢氧化钠固体;氨气密度小于空气密度,极易溶于水,应选择向下排气法收集,不能用排水法收集,收集不能用密封装置,所以只有Ⅳ符合题意;若用A装置与D装置相连制取收集X气体,制取气体的特点为:反应物为固体与液体加热,密度大于空气密度,且气体可利用浓硫酸干燥,需要尾气处理;
A.制取CO2时不需要加热也不不必处理尾气,故A错误;
B.NO不能用排空气法收集,故B错误;
C.二氧化锰与浓盐酸加热生成氯气,氯气密度大于空气密度,能够用浓硫酸干燥,氯气可以用氢氧化钠溶液吸收尾气,故C正确;
D.氢气密度小于空气 密度,故D错误;
A装置中反应的离子方程式 MnO2+4H++2Cl﹣═Mn2++Cl2↑+2H2O,
所以答案是:2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O,浓氨水和氧化钙(或碱石灰、固体氢氧化钠等);Ⅳ;C; MnO2+4H++2Cl﹣═Mn2++Cl2↑+2H2O;(3)在高温下氢化钠(NaH)可将四氯化钛(TiC14)还原成金属钛,氢元素化合价升高为+1价,钛元素化合价+4价变化为0价,则反应的化学方程式为:NaH+TiCl4 ![]() Ti+4NaCl+2H2↑,NaH能与水剧烈反应:NaH+H2O═NaOH+H2↑,NaH与液氨(NH3)也有类似反应,该反应的化学方程式为NaH+NH3═NaNH2+H2↑,每反应1molNaH电子转移总数为1mol,如果有12g NaH物质的量=
Ti+4NaCl+2H2↑,NaH能与水剧烈反应:NaH+H2O═NaOH+H2↑,NaH与液氨(NH3)也有类似反应,该反应的化学方程式为NaH+NH3═NaNH2+H2↑,每反应1molNaH电子转移总数为1mol,如果有12g NaH物质的量= ![]() =0.5mol参加此反应,电子转移0.5mol,所以答案是:TiCl4+4NaH
=0.5mol参加此反应,电子转移0.5mol,所以答案是:TiCl4+4NaH ![]() 4NaCl+Ti+2H2↑;NaH+NH3═NaNH2+H2↑;0.5;(4)SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:SiHCl3+3H2O═H2SiO3+H2↑+3HCl,氢气遇氧气易爆炸,
4NaCl+Ti+2H2↑;NaH+NH3═NaNH2+H2↑;0.5;(4)SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:SiHCl3+3H2O═H2SiO3+H2↑+3HCl,氢气遇氧气易爆炸,
所以答案是:SiHCl3+3H2O═H2SiO3↓+H2↑+3HCl↑;高温下H2与O2混合发生爆炸.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】在下列各种石油的加工处理过程中,属于裂化过程的是( )
A.分离汽油和煤油
B.将重油分离为润滑油等
C.十六烷变为辛烷和辛烯
D.将直链烃变为芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子键和离子化合物的说法正确的是( )
A. 凡含离子键的化合物,一定含金属元素
B. 在化合物MgCl2中,两个氯离子之间也存在离子键
C. 离子化合物一定能导电
D. 原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一化学反应中,其产物的总能量为60kJ,如果该反应是放热反应,那么反应物的总能量应当是( )
A. 50kJ B. 20kJ C. 30kJ D. 80kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的数据是( )
A. vA=0.5 mol /(L·s) B. vB=0.3 mol/(L·s)
C. vC=0.8 mol /(L·s) D. vD=1 mol /(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂白粉在空气中容易失效的原因是
A. 次氯酸钙不稳定,易分解 B. 氯化钙易潮解
C. 次氯酸钙易与盐酸反应 D. 次氯酸钙易和空气中的水及二氧化碳反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上或实验室提纯以下物质的方法不合理的是(括号内为杂质)( )
A.溴苯(溴):加NaOH溶液,分液
B.乙烷(乙烯):通入溴水,洗气
C.乙酸(水):加新制生石灰,蒸馏
D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中进行的反应:P(g)+ Q(g)![]() R(g)+ S(g)下列说法可以充分说明这一反应已经达到化学平衡状态的是( )
R(g)+ S(g)下列说法可以充分说明这一反应已经达到化学平衡状态的是( )
A. P、Q、R、S的浓度相等
B. P、Q、R、S在密闭容器中共存
C. P、Q、R、S的浓度不再变化
D. 用P的浓度表示的化学反应速率与用Q的浓度表示的化学反应速率相等。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com