
【题目】研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:![]() ,下列“水”电池在海水中放电时的有关说法正确的是( )
,下列“水”电池在海水中放电时的有关说法正确的是( )
A. 负极反应式:![]()
B. ![]() 不断向“水”电池的正极移动
不断向“水”电池的正极移动
C. 每生成![]() 转移5 mol电子
转移5 mol电子
D. 该电池工作时,电子由![]() 电极向Ag电极移动
电极向Ag电极移动
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】最近科学家研发了可充电“全氢电池”,其工作原理如图所示,
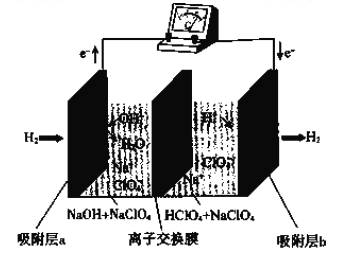
(1)吸附层a中发生反应的方程式是____________________________
(2)电池的总反应方程式是____________________________
(3)请在图中标出![]() 的移动方向 _______________________。
的移动方向 _______________________。
(4)下列说法正确的是_____________________________(选序号)。
a.![]() 可循环利用,基本不需要补充
可循环利用,基本不需要补充
b.![]() 的作用是传导离子和参与电极反应
的作用是传导离子和参与电极反应
c“全氢电池”工作时将化学能转化为电能
d.该电池充电时,吸附层b接电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是 ( )
A. 稀硫酸滴在铁片上:2Fe+6H+===2Fe3++3H2↑
B. 碳酸氢钠溶液与稀盐酸混合:HCO3-+H+=H2O+CO2↑
C. 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-===Cu(OH)2↓+![]()
D. 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-===AgCl↓+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种可溶性物质A、B、C,其中A、B属于盐,C属于碱,它们溶于水后电离产生的所有离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
请根据下列叙述回答问题:
(1)C的化学式为___。
(2)A溶液与B溶液反应可生成气体X,则X的化学式为___,该反应的离子方程式为___。
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸。
①B的化学式为___,鉴别溶液中B的阴离子的试剂为___。
②D溶于稀硝酸的离子方程式为___。
③D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为VL,则E在混合物中的质量分数的表达式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为达到实验目的,试剂或仪器或操作正确的是( )
选项 | 实验目的 | 试剂或仪器或操作 |
A | 测定中和热 | 选择浓硫酸与NaOH溶液作为试剂 |
B | 比较Cl与S的非金属性 | 将盐酸滴入 |
C | 制备氢氧化铁胶体 | 将氯化铁饱和溶液滴入沸水中,加热到红褐色 |
D | 电解法制取氯气 | 用铁作阳极电解饱和食盐水 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有Na2SO4、NaHCO3的NaCl固体提纯,制得纯净的氯化钠溶液,某学生设计了如下图所示的实验方案:

已知碳酸氢钠在加热条件下能分解成碳酸钠、二氧化碳和水,而NaCl和Na2SO4固体加热时不发生化学变化。请回答下列问题:
(1)操作①盛放药品可选用___________(填仪器名称)。
(2)操作②为什么不用Ba(NO3)2溶液,其理由是:___________________________。
(3)进行操作②后,判断SO42-已除尽的方法是:______________________________。
(4)操作③的目的是:____________________________________________________。
(5)此设计方案是否严密___________(填“是”或“否”)理由_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如下图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如下图乙所示。

请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有______(填字母)。
a.天平 b.烧杯
c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为______________________________________。
(3)AB段反应的离子方程式为______________________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是________,反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氢硫酸是一种二元弱酸,请回答以下问题:
(1)已知 0.1mol/L NaHS 溶液显碱性,则c(S2—)___c(H2S)(填“>”“<”或“=”)。
(2)常温下,向 0.2mol/L的 H2S溶液中逐滴滴入 0.2mol/L NaOH 溶液至中性,此时溶液中以下所示关系不正确的是___(填字母)。
A. c(H+)·c(OH-)=1×10-14
B. c(Na+)=c(HS—)+2c(S2—)
C. c(Na+)> c(HS—)+c(S2—)+ c(H2S)
D. c(H2S)> c(S2—)
(3)已知常温下,CaS 饱和溶液中存在平衡CaS(s) ![]() Ca2+(aq)+S2-(aq) △H>0。
Ca2+(aq)+S2-(aq) △H>0。
①温度升高时,KSP(CaS ) =___ (填“增大”“减少”或“不变”,下同)。
②滴加少量浓盐酸时,c(Ca2+ )___,原因是___(用文字和离子方程式说明)。
③若向CaS 饱和溶液中加入Cu(NO3)2 溶液中,生成一种黑色固体物质,写出该过程中反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol MnO2和100 mL 12 mol·L-1盐酸混合后缓缓加热,生成气体单质A,反应完全后向留下的溶液中加入足量AgNO3溶液 (不考虑盐酸的挥发) 。下列说法错误的是
A.在生成气体A的反应中,MnO2是氧化剂,盐酸是还原剂
B.气体单质A是氯气,它的体积是2.24L
C.生成AgCl沉淀的物质的量为1mol
D.整个反应过程被氧化的盐酸有0.4mol,并转移了0.2mol e-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com